Questões da Prova UFAC - 2010 - UFAC - Vestibular - Prova 1
Foram encontradas 10 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
A água oxigenada comercial, uma solução aquosa de peróxido de hidrogênio H2O2, é um poderoso oxidante que devido a essa propriedade possui diversos usos, como por exemplo: no clareamento de cabelos, como agente antisséptico, na medicina veterinária, no tratamento de acne, entre outros. Normalmente, a água oxigenada deve ser guardada em frascos escuros que não permitam a passagem de luz, pois o peróxido de hidrogênio se decompõe rapidamente na sua presença, segundo a reação: 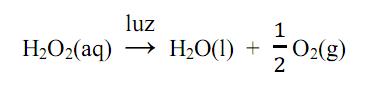
O gráfico a seguir, apresenta o perfil da decomposição H2O2 de ao longo do tempo de um experimento realizado com água oxigenada.
Considerando a reação química e o gráfico apresentados, e ainda que o tempo inicial é igual a zero, é correto afirmar que:
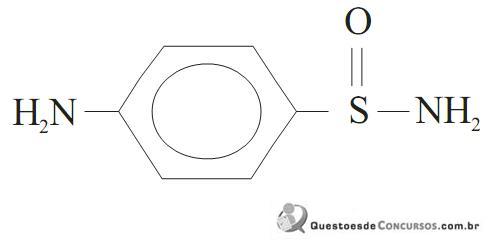
Algumas sulfonamidas podem ser potencialmente carcinogênicas e ainda podem causar efeitos colaterais, como reações alérgicas ou tóxicas em algumas pessoas.
Analisando-se os grupos funcionais presentes na p-amino benzeno sulfonamida, pode-se dizer que está presente a função:
Concentração de ácido acético: 6,0% m/V.
Ao explicar que o vinagre é uma solução aquosa de ácido acético (ácido etanóico), o professor deixou o seguinte questionamento valendo um ponto na média: “Qual o pH do vinagre?”
As seguintes informações foram fornecidas pelo professor:
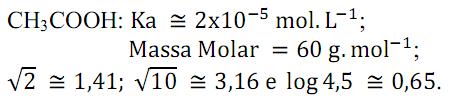
Assim, ganhará o ponto o aluno que responder que o pH é aproximadamente:
Nos aparelhos portáteis modernos, usados com freqüência na atualidade, como filmadoras, computadores, máquinas fotográficas digitais e telefones celulares, as baterias de íons de lítio vêm sendo cada vez mais utilizadas, porque possuem inúmeras vantagens frente a outros modelos, dentre eles as de níquel e cádmio e níquel metal hidreto. Além de armazenarem muito mais energia, as baterias de lítio proporcionam um tempo maior de uso sem recarga, são mais leves, não são afetadas pelo efeito memória e podem ser recarregadas sem a necessidade de esperar a descarga total. Isso sem falar que ainda diminuem o risco ambiental, principalmente quando comparadas às baterias que contém cádmio, que é um metal pesado que produz graves efeitos tóxicos aos organismos vivos, mesmo em concentrações muito pequenas.
A figura a seguir, ilustra um esquema do processo eletroquímico que ocorre nas baterias de íons de lítio. 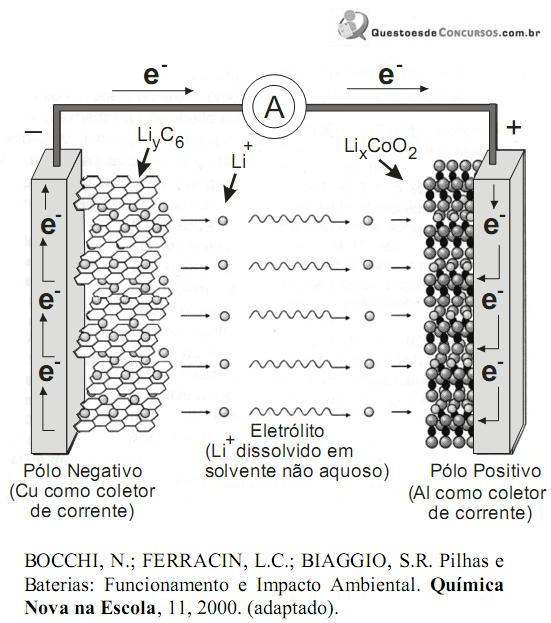
Dessa forma, na descarga da bateria, as reações químicas nos dois pólos são:
Pólo Negativo:
LiyC6 (s) → C6 (s) + y Li+ (solv.) + y e-
Pólo Positivo:
LixCoO2(s) + y li+ (solv.) + y e- → lix+yCoO2(s)
Sobre tais reações, pode-se dizer que:
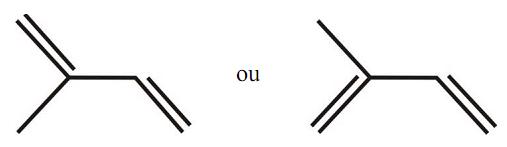
A respeito dessa molécula, é correto afirmar que: