Questões de Vestibular INSPER 2019 para Vestibular - Cursos de Engenharia - Ciências da Natureza
Foram encontradas 2 questões
A chegada do homem à Lua, há 50 anos, possibilitou a coleta das rochas lunares, cuja análise permititu datar a idade do satélite natural da Terra com maior precisão. A técnica utilizada consistiu em determinar a proporção das quantidades do radioisótopo háfnio-182 e do isótopo estável tungstênio-182 presentes nessas rochas lunares.
O processo de decaimento radioativo do háfnio-182 apresenta uma etapa intermediária, na qual se forma o radioisótopo instável tântalo-182 que, por sua vez, decai para o tungstênio-182, de acordo com a equação:
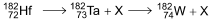
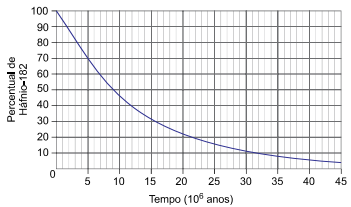
O decaimento radioativo do háfnio-182 resultando no tungstênio-182 em função do tempo ocorre de acordo com a curva apresentada no gráfico.
A emissão radioativa representada pela letra X na equação
de decaimento do háfnio-182 e a meia-vida desse radioisótopo em 106 anos são
O fenômeno climático das monções, que ocorre na Ásia, propicia a dispersão de poluentes que formam particulados, como o sulfato de amônio [(NH4)2SO4]. Esse composto é formado na atmosfera pela reação da amônia (NH3) com o dióxido de enxofre (SO2), de acordo com as equações:
SO2 (g)+ 1/2O2(g) → SO3 (g)
H2O (ℓ)+SO3(g) → H2SO4 (ℓ)
2NH3 (g) + H2SO4 (ℓ) → (NH4)2SO4 (s)
Considere os valores de entalpia-padrão de formação:
SO2 (g) 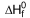 = -298 kJ/mol
= -298 kJ/mol
NH3 (g) 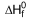 = -46 kJlmol
= -46 kJlmol
H2O (ℓ) 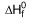 = -286 kJ/mol
= -286 kJ/mol
(NH4)2SO4 (s) 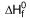 = -1179 kJ/mol
= -1179 kJ/mol
Com base nas informações apresentadas, pode-se afirmar
que a entalpia-padrão de reação de formação de 1 mol de
sulfato de amônio é
