Questões de Vestibular MACKENZIE 2010 para Vestibular
Foram encontradas 7 questões
Ano: 2010
Banca:
Universidade Presbiteriana Mackenzie
Órgão:
MACKENZIE
Prova:
Universidade Presbiteriana Mackenzie - 2010 - MACKENZIE - Vestibular |
Q1336294
Química
A qualidade da água depende integralmente de suas características físicas,
químicas e biológicas, que vão influenciar no grau de tratamento a ser dado à
água natural. Diariamente, a Companhia de Saneamento Básico de São Paulo
realiza o tratamento da água que recebemos em nossa casa. Esse tratamento é
composto de diversas fases, sendo que, inicialmente, ocorre uma coagulação, que
é quando a água recebe o sulfato de alumínio. Em seguida, vem a floculação,
realizada em tanques de concreto, onde é feito um processo de aglutinação. A
decantação ocorre logo depois e, em seguida, seguem as etapas de filtração, de
desinfecção e de fluoretação. Somente depois é que a água pode ser consumida
pelas pessoas. Trata-se de um processo lento, custoso, mas necessário para
que todas as impurezas e microrganismos sejam destruídos, e a água se torne
potável.
A adição de sulfato de alumínio é o primeiro passo desse processo e pode ser representado pela equação química NÃO BALANCEADA abaixo.
Aℓ2(SO4)3 + H2O Aℓ(OH)3 + H2SO4
Aℓ(OH)3 + H2SO4
Assim, de acordo com a equação dada, de adição de sulfato de alumínio, é correto afirmar que
Dado: massa molar em (g/mol) H = 1, O = 16, Aℓ = 27 e S = 32.
A adição de sulfato de alumínio é o primeiro passo desse processo e pode ser representado pela equação química NÃO BALANCEADA abaixo.
Aℓ2(SO4)3 + H2O
 Aℓ(OH)3 + H2SO4
Aℓ(OH)3 + H2SO4
Assim, de acordo com a equação dada, de adição de sulfato de alumínio, é correto afirmar que
Dado: massa molar em (g/mol) H = 1, O = 16, Aℓ = 27 e S = 32.
Ano: 2010
Banca:
Universidade Presbiteriana Mackenzie
Órgão:
MACKENZIE
Prova:
Universidade Presbiteriana Mackenzie - 2010 - MACKENZIE - Vestibular |
Q1336295
Química
A galvanoplastia é um processo eletroquímico que consiste em depositar um
metal sobre outro, por meio da redução química ou eletrolítica, para proteção,
para aumentar a condutividade, para aumentar a resistência ao atrito, para
melhorar a aparência e a dureza superficial, entre outros objetivos. Com base
nesses conhecimentos, uma cuba eletrolítica foi montada para a douração de um
anel de alumínio, conforme ilustração.
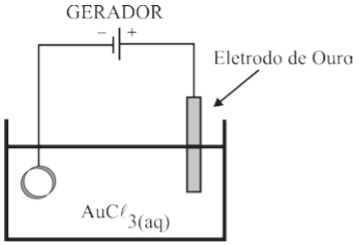
Dados: Au = 197 g/mol e 1 mol de elétrons = 9,6∙104 C.
A respeito do processo eletroquímico ilustrado acima, considere as afirmações dadas, de I a V.
I. O anel foi colocado no ânodo da cuba eletrolítica.
II. Ao passar uma corrente de 3 ampères, durante 16 minutos, há a deposição de aproximadamente 2,0 g de ouro sobre o anel.
III. No polo positivo ocorre a reação Au(s) → Au3+(aq) + 3 e-.
IV. No cátodo da cela eletrolítica ocorre oxidação.
V. No anel ocorre a reação Au3+(aq) + 3 e- → Au(s).
Dessas afirmações, estão corretas, somente

Dados: Au = 197 g/mol e 1 mol de elétrons = 9,6∙104 C.
A respeito do processo eletroquímico ilustrado acima, considere as afirmações dadas, de I a V.
I. O anel foi colocado no ânodo da cuba eletrolítica.
II. Ao passar uma corrente de 3 ampères, durante 16 minutos, há a deposição de aproximadamente 2,0 g de ouro sobre o anel.
III. No polo positivo ocorre a reação Au(s) → Au3+(aq) + 3 e-.
IV. No cátodo da cela eletrolítica ocorre oxidação.
V. No anel ocorre a reação Au3+(aq) + 3 e- → Au(s).
Dessas afirmações, estão corretas, somente
Ano: 2010
Banca:
Universidade Presbiteriana Mackenzie
Órgão:
MACKENZIE
Prova:
Universidade Presbiteriana Mackenzie - 2010 - MACKENZIE - Vestibular |
Q1336296
Química
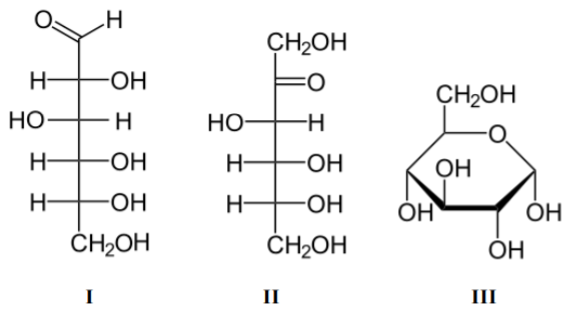
A glicose é um monossacarídeo de grande importância biológica, pois as células a usam como fonte de energia. É um cristal sólido de sabor adocicado, de fórmula molecular C6H12O6, encontrado na natureza na forma livre ou combinada. Juntamente com a frutose, é o carboidrato fundamental na formação do dissacarídeo sacarose. A molécula de glicose pode existir em forma de cadeia aberta ou cíclica, sendo que tais formas permanecem em equilíbrio. Representadas as estrututuras da D-glicose em cadeia aberta (I), D-frutose (II) e D-glicose cíclica (III), respectivamente, é INCORRETO afirmar que
Ano: 2010
Banca:
Universidade Presbiteriana Mackenzie
Órgão:
MACKENZIE
Prova:
Universidade Presbiteriana Mackenzie - 2010 - MACKENZIE - Vestibular |
Q1336297
Química
A GÊNESE DAS BOLHAS
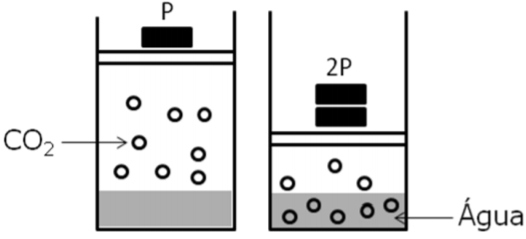
No champanhe, nos vinhos espumantes e nas cervejas, o dióxido de carbono (CO2) é o principal responsável pela formação das bolhas, originadas quando o levedo fermenta os açúcares, convertendo-os em moléculas de álcool e de CO2.
Após o engarrafamento, é estabelecido um equilíbrio entre o gás carbônico dissolvido no líquido e o gás que está no espaço sob a rolha ou a tampa.
Considerando as informações do texto, os seus conhecimentos químicos e a figura dada, é INCORRETO afirmar que

No champanhe, nos vinhos espumantes e nas cervejas, o dióxido de carbono (CO2) é o principal responsável pela formação das bolhas, originadas quando o levedo fermenta os açúcares, convertendo-os em moléculas de álcool e de CO2.
Após o engarrafamento, é estabelecido um equilíbrio entre o gás carbônico dissolvido no líquido e o gás que está no espaço sob a rolha ou a tampa.
Considerando as informações do texto, os seus conhecimentos químicos e a figura dada, é INCORRETO afirmar que
Ano: 2010
Banca:
Universidade Presbiteriana Mackenzie
Órgão:
MACKENZIE
Prova:
Universidade Presbiteriana Mackenzie - 2010 - MACKENZIE - Vestibular |
Q1336298
Química
Considere as equações termoquímicas abaixo.
I. C(graf) + O2(g) → CO2(g) ΔH°= – 394 kJ/mol
II. H2(g) + 1/2 O2(g) → H2O(ℓ) ΔH° = – 242 kJ/mol
III. C(graf) + 2 H2(g) → CH4(g) ΔH° = – 74 kJ/mol
IV. 2 C(graf) + 3 H2(g) + 1/2 O2(g) → C2H5OH(ℓ) ΔH° = – 278 kJ/mol
É correto afirmar que
I. C(graf) + O2(g) → CO2(g) ΔH°= – 394 kJ/mol
II. H2(g) + 1/2 O2(g) → H2O(ℓ) ΔH° = – 242 kJ/mol
III. C(graf) + 2 H2(g) → CH4(g) ΔH° = – 74 kJ/mol
IV. 2 C(graf) + 3 H2(g) + 1/2 O2(g) → C2H5OH(ℓ) ΔH° = – 278 kJ/mol
É correto afirmar que