Questões de Vestibular PUC - PR 2012 para Vestibular - Prova 1
Foram encontradas 3 questões
Q567771
Química
O cálculo da variação de entalpia das reações pode
ser efetuado a partir das entalpias padrão de
formação das substâncias que participam da reação.
Considere as entalpias padrão de formação (∆Hf
°
), do
CO2(g) = -393,3 kJ/mol, da H2O(-l) = -285,8 kJ/mol e da
acetona líquida é de -248,4 kJ/mol. Qual é a
quantidade aproximada de calor, em kJ, formada na
combustão completa de 290,0 g de acetona, a 25 °C?
Dados: C=12u, O = 16u, H =1u
Q567773
Química
. Um dos tipos de bafômetro usado para estimar o nível
de embriaguez de motoristas contém uma solução de
dicromato de potássio (K2Cr2O7) pela qual borbulha o
ar expirado pelo motorista, ao assoprar o canudinho.
O álcool presente nesse ar expirado reage com os
íons dicromato da solução, produz acetaldeído e íons crômio III, ocorrendo uma mudança de cor laranja
para esverdeada, numa reação de oxirredução,
conforme se apresenta a seguir:
K2Cr2O7(aq.) + H2SO4(aq.) + C2H5OH(v) → C2H4O(g) + K2SO4(aq.) + Cr2(SO4)3(aq.) + H2O(l)
Analise as afirmativas referentes a esse processo químico.
I. A equação química corretamente balanceada tem como soma dos menores números inteiros 31.
II. A equação química corretamente balanceada tem como soma dos menores coeficientes inteiros 20.
III. O etanol é oxidado a aldeído acético e o dicromato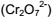 , amarelo-alaranjado, da
origem ao sulfato de íon crômio (III), verde.
, amarelo-alaranjado, da
origem ao sulfato de íon crômio (III), verde.
IV. O agente oxidante é o dicromato de potássio; portanto, ele contém o elemento que recebe elétrons, sofrendo redução.
V. O agente redutor é o ácido sulfúrico; portanto, contém o elemento que perde elétrons, sofrendo oxidação.
É correto o que se afirma APENAS em:
K2Cr2O7(aq.) + H2SO4(aq.) + C2H5OH(v) → C2H4O(g) + K2SO4(aq.) + Cr2(SO4)3(aq.) + H2O(l)
Analise as afirmativas referentes a esse processo químico.
I. A equação química corretamente balanceada tem como soma dos menores números inteiros 31.
II. A equação química corretamente balanceada tem como soma dos menores coeficientes inteiros 20.
III. O etanol é oxidado a aldeído acético e o dicromato
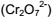 , amarelo-alaranjado, da
origem ao sulfato de íon crômio (III), verde.
, amarelo-alaranjado, da
origem ao sulfato de íon crômio (III), verde.
IV. O agente oxidante é o dicromato de potássio; portanto, ele contém o elemento que recebe elétrons, sofrendo redução.
V. O agente redutor é o ácido sulfúrico; portanto, contém o elemento que perde elétrons, sofrendo oxidação.
É correto o que se afirma APENAS em:
Q567775
Química
. Um dos metais mais importantes no mundo, dada sua
versatilidade, é o alumínio. Pode ser usado desde a
fabricação de panelas até painéis coletores de energia
solar. Apresenta propriedades peculiares: maleável,
leve (densidade abaixo de 0,5 g/cm3
) e muito
resistente à corrosão. O alumínio pode ser obtido por
meio da eletrólise da alumina (óxido de alumínio), que
é obtido pela bauxita.
(Considere 1 mol de elétrons – 96500 C)
Em relação à eletrólise, afirma-se:
I. É uma reação espontânea de oxidorredução produzida a partir da corrente elétrica.
II. Através da eletrólise ígnea do óxido de alumínio é possível obter, além de alumínio metálico, o oxigênio gasoso.
III. A redução ocorre no polo positivo denominado cátodo.
IV. A oxidação ocorre no polo positivo denominado ânodo.
V. Se numa célula eletrolítica industrial utilizarmos uma corrente elétrica de 19300 A, e admitindo uma eficiência de 90%, será possível produzir em um dia aproximadamente 140 Kg de alumínio.
Estão corretas APENAS:
(Considere 1 mol de elétrons – 96500 C)
Em relação à eletrólise, afirma-se:
I. É uma reação espontânea de oxidorredução produzida a partir da corrente elétrica.
II. Através da eletrólise ígnea do óxido de alumínio é possível obter, além de alumínio metálico, o oxigênio gasoso.
III. A redução ocorre no polo positivo denominado cátodo.
IV. A oxidação ocorre no polo positivo denominado ânodo.
V. Se numa célula eletrolítica industrial utilizarmos uma corrente elétrica de 19300 A, e admitindo uma eficiência de 90%, será possível produzir em um dia aproximadamente 140 Kg de alumínio.
Estão corretas APENAS: