Questões de Vestibular FUVEST 2016 para Vestibular - Primeira Fase
Foram encontradas 12 questões
Na estratosfera, há um ciclo constante de criação e destruição do ozônio. A equação que representa a destruição do ozônio pela ação da luz ultravioleta solar (UV) é
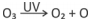
O gráfico representa a energia potencial de ligação entre um dos átomos de oxigênio que constitui a molécula de O3 e os outros dois, como função da distância de separação r.
A frequência dos fótons da luz ultravioleta que corresponde à energia de quebra de uma ligação da molécula de ozônio para formar uma molécula de O2 e um átomo de oxigênio é, aproximadamente,
Note e adote:
E = hf
E é a energia do fóton.
ƒ é a frequência da luz.
Constante de Planck, h = 6 x 10-34 Jˑs
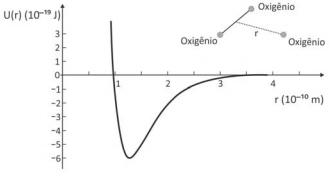
Dependendo do pH do solo, os nutrientes nele existentes podem sofrer transformações químicas que dificultam sua absorção pelas plantas. O quadro mostra algumas dessas transformações, em função do pH do solo
Para que o solo possa fornecer todos os elementos citados
na tabela, o seu pH deverá estar entre
Em ambientes naturais e na presença de água e gás oxigênio, a pirita, um mineral composto principalmente por dissulfeto de ferro (FeS2), sofre processos de intemperismo, o que envolve transformações químicas que acontecem ao longo do tempo.
Um desses processos pode ser descrito pelas transformações sucessivas, representadas pelas seguintes equações químicas:
2FeS2(s) + 7 O2(g) + 2H2O(ℓ) → 2 Fe2+(aq) + 4SO2-4(aq) + 4H+(aq)
2Fe2+(aq) + ½ O2(g) + 2H+(aq) → 2Fe3+(aq) + H2O(ℓ)
2 Fe3+(aq) + 6 H2O(ℓ) → 2 Fe(OH)3 (s) + 6 H+(aq)
Considerando a equação química que representa a transformação global desse processo, as lacunas da frase “No intemperismo sofrido pela pirita, a razão entre as quantidades de matéria do FeS2 (s) e do O2 (g) é __________, e, durante o processo, o pH do solo __________” podem ser corretamente preenchidas por
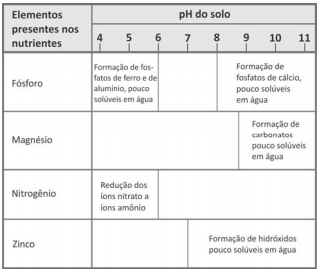
Um estudante realizou um experimento para avaliar a reatividade dos metais Pb, Zn e Fe. Para isso, mergulhou, em separado, uma pequena placa de cada um desses metais em cada uma das soluções aquosas dos nitratos de chumbo, de zinco e de ferro. Com suas observações, elaborou a seguinte tabela, em que (sim) significa formação de sólido sobre a placa e (não) significa nenhuma evidência dessa formação:
A seguir, montou três diferentes pilhas galvânicas, conforme esquematizado.
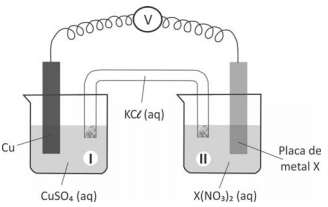
Nessas três montagens, o conteúdo do béquer I era uma solução aquosa de CuSO4 de mesma concentração, e essa solução era renovada na construção de cada pilha. O eletrodo onde ocorria a redução (ganho de elétrons) era o formado pela placa de cobre mergulhada em CuSO4 (aq).
Em cada uma das três pilhas, o estudante utilizou, no béquer II, uma placa de um dos metais X (Pb, Zn ou Fe), mergulhada na solução aquosa de seu respectivo nitrato.
O estudante mediu a força eletromotriz das pilhas, obtendo os valores: 0,44 V; 0,75 V e 1,07 V.
A atribuição correta desses valores de força eletromotriz a
cada uma das pilhas, de acordo com a reatividade dos metais
testados, deve ser
Em uma aula experimental, dois grupos de alunos (G1 e G2) utilizaram dois procedimentos diferentes para estudar a velocidade da reação de carbonato de cálcio com excesso de ácido clorídrico. As condições de temperatura e pressão eram as mesmas nos dois procedimentos e, em cada um deles, os estudantes empregaram a mesma massa inicial de carbonato de cálcio e o mesmo volume de solução de ácido clorídrico de mesma concentração.
O grupo G1 acompanhou a transformação ao longo do tempo, realizada em um sistema aberto, determinando a variação de massa desse sistema (Figura 1 e Tabela).
O grupo G2 acompanhou essa reação ao longo do tempo, porém determinando o volume de dióxido de carbono recolhido (Figura 2)

Comparando os dois experimentos, os volumes aproximados de CO2, em litros, recolhidos pelo grupo G2 após 60, 180 e 240 segundos devem ter sido, respectivamente,
Note e adote:
massa molar do CO2: 44 g/mol;
volume molar do CO2: 24 L/mol;
desconsidere a solubilidade do CO2 em água.