Questões de Vestibular de Química - Sistemas Homogêneos: Equilíbrio Iônico: Conceitos, Diluição de Ostwald, Efeito do Íon Comum.
Foram encontradas 32 questões
I. KCl(aq) + AgNO3(aq) → AgCl(s) + KNO3(aq)
II. FeCl3(aq) + SnCl2(aq) → FeCl2(aq) + SnCl4(aq)
III. Ba(OH)2(aq) + H2SO4(aq) → BaSO4(s) + H2O(l)
Nessas equações, os símbolos (aq), (s) e (l) representam, respectivamente, “espécies químicas dissolvidas em água", “espécies químicas no estado sólido" e “espécies químicas no estado líquido".
É correto afirmar que, na reação indicada, são íons espectadores
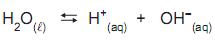
O produto iônico da água é
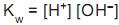 , cujo valor é 1 x
, cujo valor é 1 x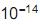 a 25 °C. Ao se adicionar 1,0 mL de NaOH 1,0 mol/L (base forte) a um copo bécher contendo 99 mL de água pura, o pH da solução será aproximadamente igual a
a 25 °C. Ao se adicionar 1,0 mL de NaOH 1,0 mol/L (base forte) a um copo bécher contendo 99 mL de água pura, o pH da solução será aproximadamente igual a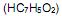 com o hidróxido de sódio. Se em uma solução aquosa 0,072 mol/L de ácido benzóico, no equilíbrio apresenta uma concentração de íons hidrônio
com o hidróxido de sódio. Se em uma solução aquosa 0,072 mol/L de ácido benzóico, no equilíbrio apresenta uma concentração de íons hidrônio 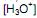 de 2,1 x 10-3 mol/L, qual é o valor de
de 2,1 x 10-3 mol/L, qual é o valor de 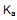 (constante de ionização ácida) deste ácido?
(constante de ionização ácida) deste ácido?PbS (s) ⇄ Pb2- (aq) + S2- (aq) S2- (aq) + 2 H- (aq)⇄ H2S (aq)
Neste gráfico, estão representadas as concentrações de Pb 2+ e S 2– , originadas exclusivamente do PbS, em função do pH da água:
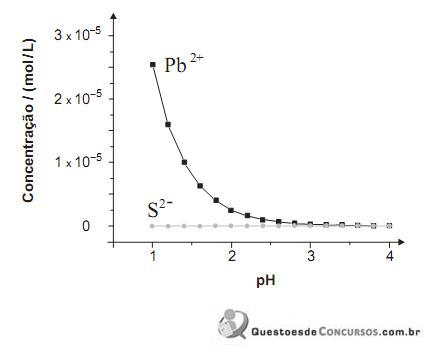
Considere que a incidência de chuva ácida sobre o mesmo lago altera a concentração das espécies envolvidas nos dois equilíbrios.
Com base nessas informações, é CORRETO afirmar que, na situação descrita,