Questões de Vestibular de Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria.
Foram encontradas 144 questões
Com o reflorestamento, é possível minimizar os efeitos do aquecimento global, tendo em vista que uma árvore consegue captar, em média, 15,6 kg do CO2 lançado na atmosfera por ano. Sabe-se que, na combustão completa da gasolina, todos os átomos de carbono são convertidos em moléculas de CO2.
Admitindo que 1 litro de gasolina contém 600 g de isoctano (C8H18) e 200 g de etanol (C2H6O), no período de 1 ano, uma árvore será capaz de captar o CO2 emitido na combustão completa de x litros de gasolina.
O valor de x corresponde, aproximadamente, a:
O Cardanol é um fenol obtido do líquido da castanha de caju (LCC), a partir do processo de aquecimento a que as castanhas são submetidas para fins alimentícios, de modo a romper a casca externa e liberar o óleo.
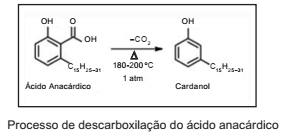
Sendo o LCC um subproduto de agronegócio do caju e
correspondente a, aproximadamente, 25% do peso da castanha, supõe-se que 5% desse líquido seja o ácido anacárdico. Assim, para produzir 5.96 toneladas de Cardanol,
supondo que sua massa molar seja de aproximadamente,
298 g/mol, a quantidade necessária de castanhas em toneladas é de:
Leia o texto para responder a questão.

Voando na altitude de cruzeiro com uma velocidade média, em relação ao solo, de 800 km/h, um Boeing 737-800 percorreu uma distância de 2400 km.
Considere que:
• o QAV é constituído por hidrocarbonetos cujas cadeias
carbônicas contêm, em média, 12 átomos de carbono
e 26 átomos de hidrogênio, apresentando massa molar
média de 170 g/mol;
• a combustão do QAV na altitude de cruzeiro é completa.
De acordo com os dados, a massa de CO2
(g) gerada pela
combustão do QAV na distância percorrida pelo avião foi próxima de
Dentre os diversos agentes tóxicos, o arsênio é historicamente famoso por se tratar de uma substância muito utilizada na Idade Média para assassinatos com interesses políticos. Podemos até dizer que a morte por arsênio foi a precursora da química forense. Na época, havia uma epidemia desses casos, cuja prevenção era muito difícil, uma vez que óxido de arsênio, As2O3, é um sólido branco, solúvel, sem cheiro e gosto, sendo dificilmente detectado por análises químicas convencionais, o que lhe deu o status de óxido do crime perfeito. Além disso, o óxido de arsênio (III) é um composto muito utilizado na fabricação de vidros e inseticidas. Ele é convertido em ácido arsenioso (H3AsO3 ) em contato com água. Um método para se determinar o teor de arsênio é por meio de oxidação com permanganato de potássio e ácido sulfúrico, conforme equação não balanceada a seguir:
H3AsO3 + KMnO4 + H2SO4 → H3AsO4 + K2SO4 + MnSO4 + H2O
Sabendo que para 2,000 g de amostra foram gastos
10,00 mL de uma solução de KMnO4 0,05 M, em que ocorre a reação acima completa, em meio de ácido sulfúrico, o
percentual de arsênio na amostra é:
O cinamaldeído é um dos principais compostos que dão o sabor e o aroma da canela. Quando exposto ao ar, oxida conforme a equação balanceada:
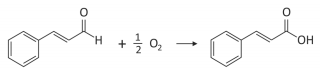
Uma amostra de 19,80 g desse composto puro foi exposta ao ar por 74 dias e depois pesada novamente, sendo que a massa final aumentou em 1,20 g. A porcentagem desse composto que foi oxidada no período foi de
Note e adote:
Massas molares (g/mol):
Cinamaldeído = 132; O2 = 32
Considere que não houve perda de cinamaldeído ou do produto de oxidação por evaporação.

