Questões de Vestibular de Química - Eletroquímica: Oxirredução, Potenciais Padrão de Redução, Pilha, Eletrólise e Leis de Faraday.
Foram encontradas 77 questões
No fragmento a seguir, o autor explora conceitos químicos na forma de poesia:
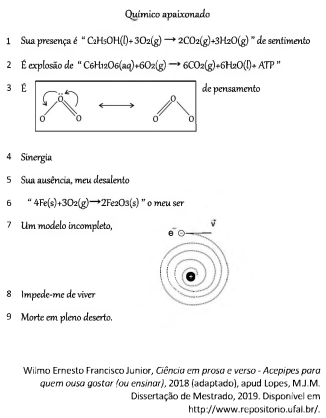
Sobre os conceitos mencionados, foram feitas as seguintes afirmações:
I. A equação química mostrada na linha 2 pode ser associada à liberação de energia, pois corresponde à reação de fotossíntese com consumo de gás carbônico.
II. A equação química apresentada na linha 6 representa uma reação na qual o número de oxidação das espécies é alterado, sendo associada a corrosão.
III. O modelo incompleto referido na linha 7 refere-se ao proposto por Thomson, que identificava a presença de partículas com carga negativa dentro de uma esfera.
Está correto o que se afirma no(s) item(ns):
Assinale a alternativa que apresenta o tempo aproximado que a célula de eletrodeposição deve ser mantida ligada, nas condições apresentadas, para que a propaganda seja verdadeira.
Dados: Massa atômica do ouro = 197 u. Constante de Faraday = 96500 C/mol de e-
Cu2+(aq) + 2e- → Cu(s) Eº = +0,34 V Fe2+ (aq) + 2e- → Fe(s) Eº = -0,44 V Zn2+(aq) + 2e- → Zn(s) Eº = -0,76 V Al3+ (aq) + 3e- → Al(s) Eº = -1,66 V
Considerando os potenciais padrão de redução apresentados, avalie as sentenças abaixo e assinale aquela quimicamente INCORRETA quanto ao processo de corrosão.

A tradição de produzir joias e semi joias em Juazeiro do Norte vem desde os tempos do Padre Cícero. Como a cidade recebia muitos visitantes para casar e não tinham alianças, surgiam daí as primeiras oficinas de joias. A galvanoplastia utiliza a eletrolise em meio aquoso para cobrir uma determinada peça metálica com outro metal. Na prateação (Ag + ) de uma aliança, fez-se passar pelas células uma corrente de 3,72 ampères durante 20 minutos. Qual a massa de prata, depositada na superfície da aliança. Dados Ag = 108
Analise as reações.
Reação 1 – Obtenção de água sanitária
Cℓ2 (g) + 2NaOH (aq) → NaCℓ O (aq) + NaCℓ (aq) + H2O (ℓ)
Reação 2 – Reação de carga de uma bateria chumbo/ácido
2PbSO4 (s) + 2H2O (ℓ) → Pb (s) + PbO2 (s) + 2H2SO4 (aq)
Reação 3 – Combustão de magnésio metálico
Mg (s) + 1/2 O2 (g) → MgO (s)
Reação 4 – Obtenção de cal
CaCO3 (s) → CaO (s) + CO2 (g)
São exemplos de oxirredução, que apresentam um reagente atuando simultaneamente como oxidante e redutor, as
reações