Questões de Concurso
Sobre substâncias inorgânicas e suas características: ácidos, bases, sais e óxidos. reações de neutralização. em química
Foram encontradas 586 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
( 1 ) NaOH 0,1 mol/L
( 2 ) NaOH 3%
( 3 ) NaOH 50 mM
( 4 ) NaOH 5 g/L
( ) Diluir 25 µL de uma solução a 3 mol/L e diluir até 100 µL.
( ) Diluir 50 mL de uma solução a 16 g/L até 200 mL.
( ) Diluir 10 mL de uma solução a 1,25 mol/L até 100 mL.
( ) Diluir 2 mL de solução a 25 % até 250 mL.
A ordem CORRETA de associação, de cima para baixo, é:
Assinale a alternativa CORRETA.
Se um precipitado de cromato de prata está em equilíbrio com sua solução saturada, pode-se afirmar que há um equilíbrio heterogêneo
PORQUE
o Ag2CrO4 está na fase sólida, enquanto íons Ag⁺ e CrO42⁻ estão na fase dissolvida, sendo a expressão do produto de solubilidade igual à soma das concentrações molares dos íons. Assinale a alternativa CORRETA.
Com base no texto acima, julgue os itens a seguir.
O NH4OH e o Fe2O3 são exemplos de compostos químicos correspondentes às funções base e óxido, respectivamente.
Com base na situação hipotética apresentada, julgue os itens que se seguem, considerando que a solução estoque de HCl, aquosa, apresenta densidade igual a 1,19 g/mL e concentração percentual em massa igual a 37,0%.
É aconselhável que seja provocado vômito em pessoa que tenha ingerido HCl ou outro ácido concentrado.
da solução de titulante.
Com base na situação hipotética apresentada, julgue os itens que se seguem, considerando que a solução estoque de HCl, aquosa, apresenta densidade igual a 1,19 g/mL e concentração percentual em massa igual a 37,0%.
O ácido clorídrico, por ser um ácido fraco, dispensa o cuidado de ser manuseado em capela.
Com base na situação hipotética apresentada, julgue os itens que se seguem, considerando que a solução estoque de HCl, aquosa, apresenta densidade igual a 1,19 g/mL e concentração percentual em massa igual a 37,0%.
Uma solução de HCl preparada a partir de uma solução estoque comercial deve ser padronizada por meio da titulação com uma solução padrão básica antes de ser utilizada como solução padrão ácida.
De posse dessa informação, o estudante fez a seguinte reflexão: “será que se algum ácido concentrado atingir minha pele, eu devo adicionar água abundante?”
Com relação à reflexão do aluno, é CORRETO afirmar que o ácido concentrado que pode gerar queimadura em sua pele quando a ele adicionar água é o
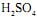 de concentração igual a 2,5 mol/L tombou e quebrou-se numa bancada de laboratório. Todo o ácido nela contido espalhou-se pela bancada. Para neutralizálo completamente pode-se utilizar, no mínimo, uma massa de cal hidratada,
de concentração igual a 2,5 mol/L tombou e quebrou-se numa bancada de laboratório. Todo o ácido nela contido espalhou-se pela bancada. Para neutralizálo completamente pode-se utilizar, no mínimo, uma massa de cal hidratada, 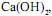 em gramas, igual a
em gramas, igual a Com o exclusivo objetivo de neutralizar o ácido, o procedimento correto deve ser o de jogar no asfalto solução aquosa de
Soluções Cor da solução na presença Cor da solução na presença Cor da solução na presença
azul de bromotimol de alaranjado de metila de fenolftaleína
1 amarela vermelha —
2 azul amarela —
3 amarela amarela incolor
4 verde — incolor
De acordo com os resultados, o técnico concluiu que as soluções 1, 2 , 3 e 4 eram, respectivamente,
Dados
cores dos indicadores em diferentes faixas de pH (valores aproximados).
Azul de bromotimol Alaranjado de metila Fenolftaleína
pH < 6,0 – cor amarela pH ≤ 3,1 – cor vermelha pH < 8,2 – incolor
pH entre 6,0 e 7,6 – cor verde pH entre 3,2 e 4,4 – cor laranja pH entre 8,2 e 10,0 – cor rosa claro
pH > 7,6 – cor azul pH > 4,4 cor amarela pH > 10 cor rosa intenso
Então, o óxido de potássio, K2O, em água, forma
I O NO é classificado como óxido neutro.
II O PbO2 é classificado como peróxido.
III O MnO2 é classificado como peróxido.
IV O óxido plumboso é classificado como óxido anfótero.
V O óxido de antimônio é classificado como anfótero.
Das afirmativas acima, são corretas apenas:
O reagente de Baumann empregado para avaliação da distribuição de enxofre na análise macrográfica de aços é composto por
2KNO3(s) + S(s) + 3C(s) -> K2S(s) + N2(g) + 3CO2(g).
Com base nessas informações, julgue o item seguinte.
A redução do nitrato, que consome três moles de elétrons por mol de NO3 – em meio ácido, gera o óxido nítrico, que é um agente complexante mais forte que o íon nitrato