Questões de Concurso
Foram encontradas 2.588 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Um objeto, em um recipiente contendo 10 mL de etanol e 30 mL de água, encontra-se em equilíbrio, conforme representado na figura a seguir:
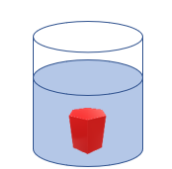
Considere que não houve contração de volume, que a água e o etanol solubilizam-se em qualquer
proporção e que as densidades da água e do etanol são, respectivamente, 1,0 g.mL-1 e 0,8 g.mL-1
.
Com essas informações, é correto afirmar que o valor aproximado da densidade do objeto será de
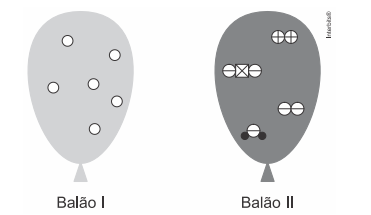
Os componentes presentes em cada balão são classificados, respectivamente, como substância
Na tabela abaixo, considere os pontos de fusão (PF) e ebulição (PE), a 1 atm de pressão, das substâncias elencadas.
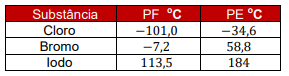
Em um ambiente com a mesma condição de temperatura do Vale da Morte e pressão atmosférica igual a 1 atm, as substâncias cloro, bromo e iodo apresentam-se, respectivamente, nos estados físicos
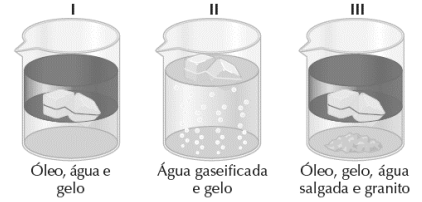
O número de fases e de componentes em cada um é respectivamente:
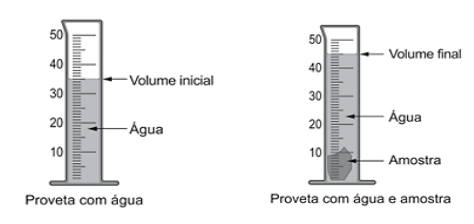
Considerando que a amostra apresenta uma massa de 30 gramas, é correto afirmar que sua densidade apresenta um valor de, aproximadamente,