Questões de Concurso Comentadas para seduc-pe
Foram encontradas 53 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
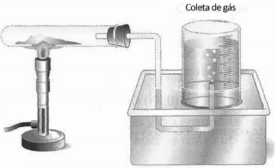
A reação observada pode ser representada pela equação: 2 KClO3 → 2 KCl + 3 O2 Uma amostra de clorato de potássio foi parcialmente decomposta sendo a pressão do gás recolhido de 0,8 atm e seu volume de 180 mL na temperatura de 27ºC. Considerando o comportamento ideal do gás, a massa de clorato de potássio que sofreu decomposição foi de, aproximadamente, Dados: Massa Molar: KClO3 = 122,5 g.mol-1 Constante real dos gases R= 0,082atm.L.mol-1 .K-1
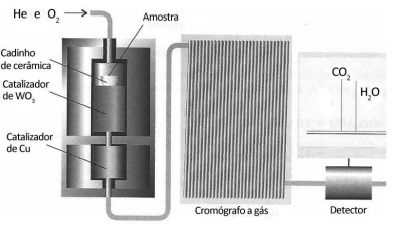
Na análise por combustão de 6,0 g de um hidrocarboneto recém-sintetizado foi determinada a massa de 17,6 g de dióxido de carbono e 10,8 g de água. A fórmula empírica desse composto é: Dados: Massas Molares: H = 1g.mol–1 C = 12g.mol–1 O=16g.mol–1
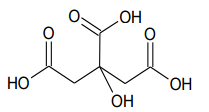
Assinale a opção que expressa a acidez da amostra. Dados. Massa molar. Ácido Cítrico: 192 g.mol –1 .