Questões da Prova CESPE - 2014 - INPI - Pesquisador em Propriedade Industrial (Classe A, Padrão I) - Cargo 2
Foram encontradas 120 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
O monofilamento de seda consiste na fiação, pelo bicho-da-seda, dentro de um casulo. A lagarta emite, pelo orifício em sua cabeça, dois fios paralelos e viscosos, os quais formarão um único fio quando a substância sericina se solidificar. O filamento que sai dos casulos é bastante fino; por isso, serão necessários muitos casulos, uma vez que vários filamentos deverão ser enrolados e torcidos até constituírem um só fio de seda natural.
Os elétrons passam do ânodo para o cátodo, os cátions movem-se através do eletrólito na direção do cátodo e os ânions na direção do ânodo.
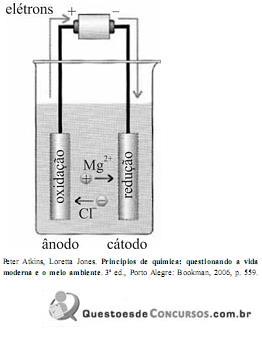
Com base nas informações e na figura acima, julgue o item.
Na célula eletrolítica mostrada na figura, a ponte salina foi removida para que os elétrons fluíssem mais rapidamente do ânodo para o cátodo.
Os elétrons passam do ânodo para o cátodo, os cátions movem-se através do eletrólito na direção do cátodo e os ânions na direção do ânodo.

Com base nas informações e na figura acima, julgue o item.
Na célula eletrolítica apresentada, o magnésio é decantado da água do mar e, então, convertido em cloreto por tratamento com ácido clorídrico. Após a evaporação da água,o MgCl2 é fundido e eletrolisado e a reação global resultante é: MgCl2 → Mg(l) + Cl2(g).
Os elétrons passam do ânodo para o cátodo, os cátions movem-se através do eletrólito na direção do cátodo e os ânions na direção do ânodo.

Com base nas informações e na figura acima, julgue o item.
A galvanização é um método utilizado para prevenir a corrosão de metais, em que um primeiro metal é encoberto por um segundo metal, devendo este segundo, para isso, estar abaixo do primeiro na série eletroquímica, uma vez que, ao sofrer deterioração, o segundo libera seus elétrons para o primeiro. Dessa forma, é correto afirmar que a galvanização é um processo eletroquímico.
Os elétrons passam do ânodo para o cátodo, os cátions movem-se através do eletrólito na direção do cátodo e os ânions na direção do ânodo.

Com base nas informações e na figura acima, julgue o item.
Considerando-se que “fund" significa sal fundido, é correto afirmar que as semirreações correspondentes ao diagrama apresentado na figura acima e as reações ocorridas no ânodo e no cátodo são:
reação do ânodo: Mg2+ (fund) + 2e- → Mg(l);
reação do cátodo: 2Cl- (fund) → Cl2(g) + 2e .