Questões da Prova IF-SC - 2014 - IF-SC - Professor - Química
Foram encontradas 40 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Dentro desse contexto, leia com atenção as afirmações a seguir e marque V para as verdadeiras e F para as falsas:
( ) Na análise titrimétrica, trata-se a substância a ser determinada com um reagente adequado, na forma padronizada, e determina-se o volume necessário para completar a reação.
( ) A análise térmica diferencial registra a diferença de temperatura de uma substância, antes e depois de reagir com um material de referência.
( ) Na espectroscopia de absorção atômica, o material a ser analisado é vaporizado sob vácuo e o vapor é submetido a um feixe de elétrons de alta energia.
( ) Os métodos espectrométricos de análise dependem da medida da quantidade de energia radiante, com um determinado comprimento de onda, que é absorvida ou emitida pela amostra.
( ) Os métodos de emissão submetem a amostra a um tratamento térmico ou elétrico que leva os átomos a estados excitados que emitem energia. A intensidade dessa energia é, então, medida. São exemplos dessa técnica, a fotometria de chama e a fluorimetria.
Assinale a alternativa que contém a sequência CORRETA de cima para baixo.
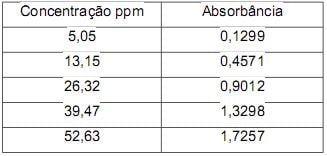
Com esses dados, os alunos fizeram a regressão linear, obtendo a equação da reta (y = a.x + b), com os seguintes valores: R2 = 0,9979; a = 0,0333; b = - 0,0023.
Com base nesse experimento, julgue (V) verdadeiro ou (F) falso os itens a seguir.
( ) A concentração de flavonoides no suco de uva da cantina será de 25 ppm de a absorbância apresentada em 510 nm for de 0,8302.
( ) A concentração de flavonoides no suco de uva será de 0,01% se a absorbância for de 0,3307.
( ) O valor da absorbância dos flavonoides do suco de uva não vai ser alterado em função do caminho óptico.
( ) A temperatura e o tipo de solvente são fatores que não influenciam as absortividades molares das substâncias.
Assinale a alternativa que apresenta a sequência CORRETA de cima para baixo.
Ka do ácido fórmico (HCOOH) = 0,00018
pKa do ácido benzóico (C6H5COOH) = 4,20
Analise as asserções a seguir.
Tanto o ácido fórmico quanto o ácido benzóico são considerados ácidos fracos, porém o ácido fórmico é um ácido mais fraco que o ácido benzóico
PORQUE
o ácido benzóico estabiliza bem a carga iônica por ressonância no anel aromático, ionizando- se em maior proporção que o ácido fórmico quando em solução aquosa.
Assinale a alternativa CORRETA.
NH4NO3 ? 2N2 + 4H2O + O2
O nitrato de amônio é produzido pela simples neutralização do ácido nítrico, pelo amoníaco segundo a reação:
NH3(g) + HNO3(aq) ? NH4NO3(aq)
Em um estudo sobre a cinética dessa reação foram obtidos os seguintes dados:
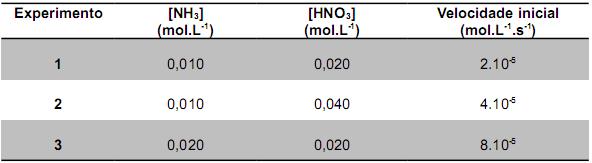
Como base nesses dados cinéticos e na estequiometria da reação, assinale a alternativa CORRETA.
Assinale a alternativa CORRETA.