Questões da Prova VUNESP - 2014 - SAAE-SP - Químico
Foram encontradas 50 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
A figura seguinte mostra o espectro de absorção da luz pelas clorofilas a e b, em diferentes comprimentos de onda.
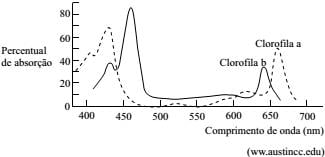
De acordo com os dados do espectro, a determinação da concentração de clorofila a em amostras de água, independentemente de medidas para corrigir turbidez e presença de produtos de decomposição da clorofila a, deve ser feita no comprimento de onda correspondente aos máximos de absorção entre
Sobre essa solução, é correto afirmar que
Dado: massa molar Mg(NO3 )2= 148 g. mol –1
Pesou- se 500 mg de solo em um erlenmeyer de capacidade para 125 mL. Adicionou- se 10 mL de solução de ácido nítrico (1:1) ao erlenmeyer e este foi tampado com vidro relógio. O conjunto foi aquecido a aproximadamente 95 °C, em uma placa de aquecimento, por 15 minutos, sem ebulição. Em seguida, foram adicionados 5 mL de ácido nítrico concentrado e o material foi colocado sob refluxo por 1 h. Adicionou- se 2 mL de água deionizada e 8 mL de água oxigenada, deixando em reação por 1 h. Por último, adicionouse 5 mL de ácido clorídrico concentrado e 10 mL de água deionizada, colocando sob refluxo por 15 minutos. Após esfriar, o material foi transferido quantitativamente, lavando- se o erlenmeyer com pequenas proporções de ácido clorídrico (1:100) para um funil com papel de filtro faixa azul (filtração lenta) e o filtrado coletado em balão volumétrico de 50 mL. Após completar o volume, foram feitas as determinações dos teores de metais utilizando um espectrômetro de emissão ótica com plasma induzido.
(www.iac.sp.gov.br.dissertacoes/Thabata Godoy.pdf. Fragmento. Acesso em abril de 2014.
Pesou- se 500 mg de solo em um erlenmeyer de capacidade para 125 mL. Adicionou- se 10 mL de solução de ácido nítrico (1:1) ao erlenmeyer e este foi tampado com vidro relógio. O conjunto foi aquecido a aproximadamente 95 °C, em uma placa de aquecimento, por 15 minutos, sem ebulição. Em seguida, foram adicionados 5 mL de ácido nítrico concentrado e o material foi colocado sob refluxo por 1 h. Adicionou- se 2 mL de água deionizada e 8 mL de água oxigenada, deixando em reação por 1 h. Por último, adicionouse 5 mL de ácido clorídrico concentrado e 10 mL de água deionizada, colocando sob refluxo por 15 minutos. Após esfriar, o material foi transferido quantitativamente, lavando- se o erlenmeyer com pequenas proporções de ácido clorídrico (1:100) para um funil com papel de filtro faixa azul (filtração lenta) e o filtrado coletado em balão volumétrico de 50 mL. Após completar o volume, foram feitas as determinações dos teores de metais utilizando um espectrômetro de emissão ótica com plasma induzido.
(www.iac.sp.gov.br.dissertacoes/Thabata Godoy.pdf. Fragmento. Acesso em abril de 2014.
Sabendo que, a 25 °C,
H3 PO4(aq)
 H3 O+ (aq) + H2 PO4 – (aq) Ka = 7,6 x10–3
H3 O+ (aq) + H2 PO4 – (aq) Ka = 7,6 x10–3H2 O ( l )
 H3 O+ (aq) + OH– (aq) Kw = 1,0 x 10–14
H3 O+ (aq) + OH– (aq) Kw = 1,0 x 10–14estima- se que o pH da solução aquosa de NaH2 PO4 , a 25 ºC, deve ser próximo a