Questões de Concurso Sobre sistemas homogêneos: solubilidade dos sais, hidrólise dos sais e curvas de titulação. em química
Foram encontradas 173 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Cr2O72- + 14 H+ + 6 Fe2+ → 2 Cr3+ + 6 Fe3+ + 7 H2O
50,00mL de amostra, livre de interferentes, foi tratada com 25,00mL de solução de K2Cr2O7 com concentração igual a 0,04167mol.L-1 , além de H2SO4 e Ag2SO4. A titulação do excesso de dicromato na amostra consumiu 12,50mL de solução de sulfato ferroso amoniacal 0,2500mol.L-1 . A titulação do branco consumiu 25,00mL de solução de sulfato ferroso amoniacal 0,2500mol.L-1 .
Dado: Massa molar de O2 = 32,00 g.mol-1 .
A DQO da amostra, expressa em mgO2 L-1 , é igual a
Situação hipotética: Um minério contendo magnetita (Fe3O4) foi analisado pela dissolução de uma amostra em HCl concentrado, o que resultou em uma mistura de Fe2+ e Fe3+. Depois de adicionado HNO3 para oxidar o Fe2+ a Fe3+, a solução resultante foi diluída com água e todo o Fe3+ foi precipitado como Fe(OH)3 pela adição de NH4OH. Após filtragem e enxágue, o resíduo foi calcinado, resultando em Fe2O3 puro. Assertiva: Nesse caso, a massa de Fe3O4 presente na amostra é corretamente calculada multiplicando-se por 2/3 a massa de Fe2O3 obtida ao final do processo.
Situação hipotética: Dois ácidos monopróticos, um forte e um fraco, têm a mesma concentração e o mesmo volume inicial e foram titulados com uma mesma solução de NaOH. O gráfico a seguir mostra as curvas de titulação desses dois ácidos monopróticos.
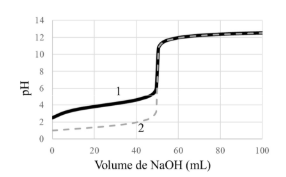
Assertiva: No gráfico, a curva 1 representa a titulação do ácido fraco.
MS(s) → M+2 + S–2 H2S → H+ + HS– HS– → H+ + S–2
Assinale a alternativa que apresenta corretamente a expressão que relaciona a solubilidade (s) do composto MS com o pH da solução.
( ) A análise gravimétrica é um método analítico em que são utilizadas somente medições de massa e informações sobre estequiometria de reação para determinar a quantidade de um analito em uma amostra.
( ) Um precipitado deve apresentar as seguintes características no produto final: ter composição conhecida e constante, não ser higroscópico, ser formado de partículas pequenas, ser muito puro e pouco solúvel.
( ) Precipitados são formados por dois processos: por nucleação e por crescimento de partículas.
( ) A filtração é a separação da fase sólida contendo o precipitado desejado da solução-mãe utilizando papel de filtro combinado com funil de vidro, ou, mais comumente, cadinhos filtrantes de vidro sinterizado.
( ) A peptização é um processo no qual os compostos normalmente solúveis são removidos da solução por um precipitado.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é: