Questões da Prova FGV - 2016 - SEE-PE - Professor de Química
Foram encontradas 7 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
O ácido benzoico foi descoberto no século XVI e recebeu esse nome por ter sido extraído do benjoeiro.
Em 1875, Salkowski verificou que esse ácido atua como fungicida
e, desde então, o ácido benzoico vem sendo usado como
germicida na preservação de alimentos e como adjuvante
farmacológico anti-fúngico, normalmente em concentrações que
variam entre 0,05 a 0,15%. Trata-se de um composto de fórmula
molecular C7H6O2 (massa molar = 122 g.mo -1) pouco solúvel em
água.
-1) pouco solúvel em
água.
Em uma solução aquosa, comporta-se como um ácido fraco, com pKa = 4.
Uma solução aquosa de ácido benzoico em concentração 0,12%
(m/v) apresenta pH aproximadamente igual a
Na determinação do teor de acidez de uma amostra de suco de laranja comercial, 10,00 mL de amostra foram levados para erlenmeyer. Adicionou-se água destilada até completar cerca de 50 mL, 3 gotas de fenolftaleína e titulou-se contra solução padrão de NaOH até mudança de coloração. Na titulação, foram gastos 3,90 mL de solução padrão 0,100 mol.L-1.
A acidez é expressa em termos do teor (porcentagem massa/volume) de ácido cítrico, cuja fórmula estrutural é apresentada a seguir.
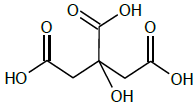
Assinale a opção que expressa a acidez da amostra.
Dados. Massa molar. Ácido Cítrico: 192 g.mol-1.
 : 74,5; BaSO4: 233
: 74,5; BaSO4: 233A análise da concentração de ortofosfato em corpos d’água pode ser feita utilizando o método colorimétrico. Nesse método, o reagente combinado contendo K(SbO)C4H4O6, (NH4)6Mo7O24 e ácido ascórbico reage em meio ácido com o ortofosfato, produzindo uma cor azul, cuja intensidade é determinada no espectrofotômetro.
No preparo de 100 mL do reagente combinado utiliza-se 5 mL de uma solução de K(SbO)C4H4O6 3,5 g.L-1 e 15 mL de uma solução de (NH4)6Mo7O24 40 g.L-1.
Nessa solução do reagente combinado as concentrações
aproximadas (em g.L-1 ) de K(SbO)C4H4O6 e de (NH4)6Mo7O24 são,
respectivamente,
O fósforo é absorvido pelas plantas na forma de ânions; um desses ânions é o (H2PO4 )- derivado da fluorapatita, encontrada em rochas.
A fluorapatita, representada como Ca5 (PO4 )3F, é insolúvel em água e é convertida a di-hidrogenofosfato de cálcio através da reação não balanceada:
Ca5 (PO4 )3F (s) + H2SO4 (aq) → Ca(H2PO4)2 (aq) + CaSO4 (aq) + HF (g)
A soma dos menores coeficientes inteiros que balanceiam esta
equação é