Questões da Prova FGV - 2016 - SEE-PE - Professor de Química
Foram encontradas 29 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
O posicionamento dos metaloides entre os metais e os não-metais é o nosso primeiro exemplo das tendências na variação das propriedades quando nos deslocamos na tabela periódica. Frequentemente veremos que, à medida que mudamos de posição em um período ou em um grupo, as propriedades físicas e químicas variam de modo mais ou menos regular. Há poucas variações abruptas nas características dos elementos quando nos deslocamos horizontalmente ao longo de um período ou verticalmente através de um grupo.
(Brady, J.; Senese, F. Química a matéria e suas transformações Vol 1, 5ª Ed. Rio de janeiro: LTC. 2009)
Com relação aos raios dos átomos, analise as afirmativas a seguir.
I. O raio do ferro é menor que o raio do potássio.
II. O raio do paládio é maior que o raio do níquel.
III. O raio do manganês e maior que o raio do estrôncio
Está correto o que se afirma em
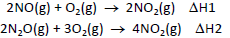
A variação de entalpia da reação N2O(g) + 1/2O2 (g) → 2NO(g) pode ser determinada como
 )
) Esta reação, descoberta pelo químico francês Paul Sabatier, tem sido estudada para remover CO2 de atmosferas artificiais como em espaçonaves. Considerando que um indivíduo libere para o ambiente 0,6 kg de dióxido de carbono por dia, e que 80% desse gás será removido pelo processo de Sabatier, a massa de metano produzida por dia é de Dados: Massas Molares: H = 1g.mol-1 C = 12g.mol-1 O=16g.mol-1
Uma técnica usada em laboratórios químicos é a determinação das fórmulas empíricas (mínimas) pela análise por combustão. Nesse processo, queima-se uma amostra em um tubo por onde passa um fluxo abundante de oxigênio, sendo todo o hidrogênio do composto convertido em água e todo o carbono convertido em dióxido de carbono.
O equipamento utilizado é representado pela figura a seguir.
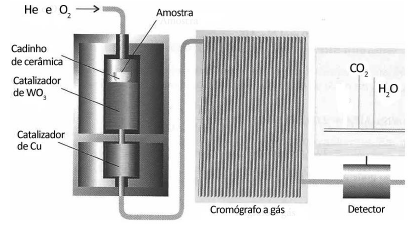
Na análise por combustão de 6,0 g de um hidrocarboneto recém-sintetizado foi determinada a massa de 17,6 g de dióxido de carbono e 10,8 g de água.
A fórmula empírica desse composto é:
Dados: Massas Molares: H = 1g.mol-1 C = 12g.mol-1 O=16g.mol-1