Questões da Prova IF-SC - 2014 - IF-SC - Professor - Química
Foram encontradas 20 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
( ) As pilhas que não podem ser recarregadas são classificadas como sistemas eletroquímicos primários ou baterias primárias.
( ) O destino ideal de pilhas e baterias usadas deveria ser o aterro controlado, pois todo o lixo recebe uma cobertura de PVC ou argila, o que evita contaminação do ambiente.
( ) As baterias de níquel/cádmio são baterias secundárias e de longa duração.
( ) Na pilha alcalina não há formação de gás hidrogênio, pois o meio é básico.
( ) Nas pilhas de mercúrio, usadas em relógios e calculadoras, o mercúrio é oxidado a óxido de mercúrio, que é solúvel e pode contaminar o solo se descartada incorretamente.
Assinale a opção que contenha a sequência CORRETA de cima para baixo.
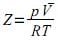
A respeito dos gases ideais e reais, assinale a alternativa CORRETA.
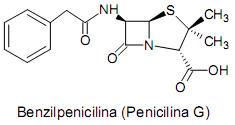
As amidas podem ser preparadas pela reação de um cloreto de ácido com uma amina, então, na intensão de produzir um repelente de insetos muito utilizado pela indústria cosmética conhecido como DEET, com nomenclatura IUPAC de N,N-dietil-3-metilbenzamida, assinale a alternativa CORRETA que indica quais reagentes um químico deve procurar em seu almoxarifado:
lEm 1913, há mais de 100 anos, Alfred Werner foi honrado com o Prêmio Nobel de Química por seu brilhante trabalho sobre a ligação existente em complexos de coordenação. No final do século XIX, ele concluiu que nos complexos o metal possui dois tipos de valência: a primária (que hoje entendemos como a carga iônica do complexo formado) e a secundária (que corresponde ao número de ligantes coordenados com o íon central). Atualmente as ligações nos compostos de coordenação são explicadas pelas Teorias da Ligação de Valência (TLV), do Campo Cristalino (TCC) e do Orbital Molecular (TOM), porém, a Teoria de Werner ainda hoje continua útil para estudos sobre algumas propriedades dos compostos de coordenação, como a estereoquímica.
Em uma aula prática de química, os estudantes formaram alguns complexos em solução. Com o objetivo de estimular os alunos a buscarem informações extras sobre o assunto tratado em aula, o professor exigiu uma pesquisa sobre os compostos.
Observe os compostos formados, considere sua conformação tridimensional e associe a coluna da direita com a da esquerda.
(1) [Pt(NH3)2CI2]
(2) [Pt(NH3)4Cl2] 2+
(3) [Co(NH3)5Cl] 2+
(4) [Pt(NH3)3Cl3] +
( ) A valência primária é 2 e a secundária é 6; não apresenta isômeros.
( ) A carga do metal é 2+ e apresenta isomeria óptica
( ) Possui dois isômeros Fac (facial) e Mer (meridional).
( ) Possui conformação octaédrica com dois isômeros Cis e Trans.
Assinale a alternativa que apresenta a ordem CORRETA de associação, de cima para baixo.
( ) A conformação de menor tensão estérica para o composto cis-1-tert-butil-4- bromocicloexano é a conformação onde o grupo tert-butila é equatorial e o bromo, axial.
( ) Considerando que a interação gauche entre os grupamentos metila gera uma tensão estérica de 3,8 KJ/mol e as interações axiais CH3 ? H geram tensão estérica de mesmo valor (3,8 KJ/mol), pode-se dizer que para o composto trans-,2-dimetilcicloexano não há diferença de energia entre a conformação da molécula que mantém os grupos metila em posições axiais e a conformação que as mantém em posições equatoriais.
( ) Na conformação de compostos cis-1,3-dissubstituídos, só é possível os substituintes de uma mesma molécula permanecerem ao mesmo tempo em posição axial ou equatorial, enquanto nos compostos trans-1,3-dissubstituídos, os substituintes de uma mesma molécula, ao contrário, não permanecerão ao mesmo tempo em posição axial ou equatorial.
( ) O substituinte tert-butil causa maior tensão 1,3-diaxial em um cicloexano monossubstituído que o isopropil.
Assinale a alternativa que contém a sequência CORRETA de cima para baixo.