Questões da Prova FUNRIO - 2014 - IF-BA - Técnico de Laboratório - Química
Foram encontradas 18 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
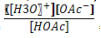 = 1,75 x 10-5 e Massa molar de
NaOAc = 82,034 g )
= 1,75 x 10-5 e Massa molar de
NaOAc = 82,034 g )
Coloração típica de chamas devido à presença de alguns cátions em estado excitado
Elemento Cor da chama Elemento Cor da chama
Antimônio Azul-esverdeada Cobre Verde
Arsênio Azul Estrôncio Vermelho-tijolo
Bário Verde-amarelada Lítio Carmin
Cálcio Alaranjada Potássio Violeta
Chumbo Azul Sódio Amarela