Questões de Concurso Público UFPR 2018 para Químico
Foram encontradas 4 questões
Q925956
Química
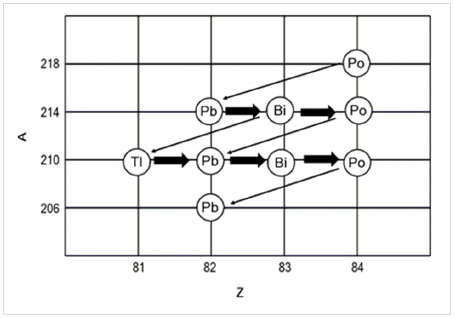
Alguns núcleos são instáveis e tendem a sofrer
decaimento até que um núcleo mais estável seja
formado. Esses núcleos decaem uma série de
etapas e dão origem a uma série radioativa. Na
figura a seguir, está mostrado o decaimento do 218Po até 206Pb.
Com relação a decaimento, considere as seguintes equações:
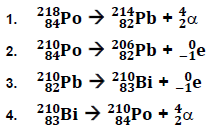
São equações de decaimento:
Com relação a decaimento, considere as seguintes equações:
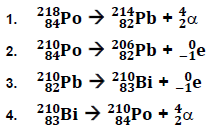

São equações de decaimento:
Q925967
Química
A energia livre de Gibbs (G) é uma função de estado termodinâmica que combina as duas funções de estado, entalpia (H)
e entropia (S). Para processos que ocorrem a temperatura constante, tem-se que ∆G = ∆H – T∆S. Para um processo ou
reação ocorrendo a temperatura e pressão constantes, o sinal de ∆G relaciona-se à espontaneidade do processo. Nesse
sentido, sobre a termodinâmica das reações químicas, identifique como verdadeiras (V) ou falsas (F) as seguintes
afirmativas:
( ) Se ΔG = 0, a reação não ocorre. ( ) Uma reação espontânea ocorre em qualquer sentido (direto e indireto). ( ) Se ΔG < 0, a reação é espontânea no sentido direto (reagentes→ produtos). ( ) Se ΔG > 0, a reação é espontânea no sentido indireto (produtos→reagentes).
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
( ) Se ΔG = 0, a reação não ocorre. ( ) Uma reação espontânea ocorre em qualquer sentido (direto e indireto). ( ) Se ΔG < 0, a reação é espontânea no sentido direto (reagentes→ produtos). ( ) Se ΔG > 0, a reação é espontânea no sentido indireto (produtos→reagentes).
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
Q925968
Química
Uma vez que entalpia (H) é uma função de estado, ∆H depende apenas dos estados inicial e final do sistema. A variação
de entalpia de um processo é a mesma se o processo for realizado em uma etapa ou em uma série de etapas. Com base
nisso, considere a transformação do carbono grafita em carbono diamante. Sabendo que a entalpia de combustão da
grafita é -393,5 kJ mol-1
, e que a entalpia de combustão do diamante é -395,4 kJ mol-1
, qual é a entalpia de conversão, em
kJ mol-1
, de 2 mols de grafita em diamante?
Q925971
Química
A diferença de potencial entre dois eletrodos em uma célula voltaica fornece a força eletromotriz que empurra os elétrons
por um circuito externo. Para uma pilha, essa força é denominada potencial da célula (E). Sob condições-padrão
(concentração das soluções de 1 mol L-1
, pressão 1 atm e 25 ºC), tem-se o potencial-padrão da célula (Eºcélula), que pode
ser determinado pela diferença dos potenciais-padrão de redução das reações que acontecem no catodo (Eºcatodo) e anodo
(Eºanodo). Sabendo que os Eº das células voltaicas Zn-Cu2+, Ni-Cu2+ e Zn-Fe2+ são +1,10, +0,62 e +0,32 V, respectivamente,
assinale a alternativa que apresenta o Eº da célula voltaica Fe-Ni2+
.
(Ordem dos Eº: Cu2+>Ni2+>Fe2+>Zn2+; Fe2+(aq) + 2e- → Fe(s) Eº = -0,44 V).