Questões de Concurso Público UFMG 2018 para Químico
Foram encontradas 10 questões
Ano: 2018
Banca:
UFMG
Órgão:
UFMG
Provas:
UFMG - 2018 - UFMG - Químico
|
UFMG - 2018 - UFMG - Químico II |
Q1759275
Química
O ácido acetilsalicílico (AAS) é um ácido monoprótico fraco, de massa molar = 180,2 g mol-1
e pKa = 3,5. É utilizado como analgésico, antipirético e anti-inflamatório. Considerando-se que essa
molécula é absorvida somente na forma protonada (ácida) no estômago, calcule a massa de AAS
absorvida, após a ingestão de 540,6 mg do ácido, juntamente com um antiácido, que elevou o pH do
estômago para 3,5.
Q1759277
Química
Na análise gravimétrica, quando ocorre a precipitação rápida, ocorre uma série de problemas.
Nas alternativas a seguir estão apresentados problemas associados a uma explicação correta acerca desses problemas, EXCETO:
Nas alternativas a seguir estão apresentados problemas associados a uma explicação correta acerca desses problemas, EXCETO:
Q1759278
Química
Na espectrometria atômica em chama, algumas amostras não são adequadamente atomizadas por
formarem compostos refratários, ao evaporar-se o solvente. Nesses casos, podem-se utilizar chamas
mais quentes, pela utilização de óxido nitroso (N2O), como comburente, no lugar do ar comprimido. No
entanto, temperaturas muito elevadas podem gerar interferências de ionização, nas quais o átomo que
deveria absorver ou emitir luz encontra-se parcialmente ionizado, reduzindo o sinal, uma vez que os
íons formados não absorvem, ou emitem, luz no mesmo comprimento de onda do átomo em questão.
Essa interferência pode ser eliminada pela adição às amostras e aos padrões de um supressor de
ionização, como o KCl.
Com relação à interferência de ionização é CORRETO afirmar que
I - o supressor de ionização é um sal que contém um metal facilmente ionizável, que, ao se ionizar reduz a temperatura da chama, impedindo a ionização do analito. II - a supressão da ionização se dá pelo deslocamento de equilíbrio gerado pelo aumento da pressão parcial de elétrons na chama, após a ionização do supressor. III - a interferência de ionização é multiplicativa. Quando observada em uma curva de calibração, acarreta um coeficiente angular mais baixo, do que o obtido após a adição do supressor de ionização. IV - os elementos de fácil ionização, como os metais alcalinos, podem apresentar essa interferência, mesmo em chamas de acetileno/ar.
Em relação a essas afirmativas, estão CORRETAS:
Com relação à interferência de ionização é CORRETO afirmar que
I - o supressor de ionização é um sal que contém um metal facilmente ionizável, que, ao se ionizar reduz a temperatura da chama, impedindo a ionização do analito. II - a supressão da ionização se dá pelo deslocamento de equilíbrio gerado pelo aumento da pressão parcial de elétrons na chama, após a ionização do supressor. III - a interferência de ionização é multiplicativa. Quando observada em uma curva de calibração, acarreta um coeficiente angular mais baixo, do que o obtido após a adição do supressor de ionização. IV - os elementos de fácil ionização, como os metais alcalinos, podem apresentar essa interferência, mesmo em chamas de acetileno/ar.
Em relação a essas afirmativas, estão CORRETAS:
Q1759280
Química
Uma engarrafadora de bebidas suspeitou que um de seus produtos estivesse contaminado por chumbo.
Sabendo que este é um metal altamente tóxico e que o teor máximo de Pb permitido na tequila é de
0,10 mg L-1, a empresa solicitou a um laboratório a análise de chumbo na tequila engarrafada. Para
a determinação da quantidade de chumbo mediu-se 20,00 mL da amostra, adicionou-se 1,00 mL de
ácido nítrico e a mistura foi transferida para um balão volumétrico de 100,0 mL (balão 1). Para a análise,
através da espectrometria de absorção atômica, foi preparada uma curva de adição de padrão, em
balões de 50,00 mL, onde foram adicionados 10,00 mL da amostra diluída (do balão 1). A curva obtida,
após regressão linear (vide figura) foi A = 0,120 + 6,0 CPb adic..
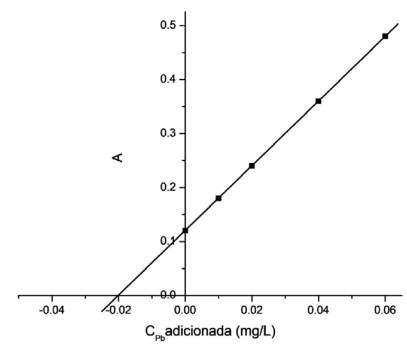
Com base nos resultados, o teor de chumbo da amostra de tequila analisada é:

Com base nos resultados, o teor de chumbo da amostra de tequila analisada é:
Q1759282
Química
A iodometria indireta é um método amplamente utilizado para a dosagem de agentes oxidantes diversos, como peróxido de hidrogênio, oxigênio dissolvido, bromato, nitrito, entre outros. A dosagem se dá, adicionando-se KI em excesso à amostra e titulando-se o I2 produzido com uma solução padrão de tiossulfato. O tiossulfato pode ser padronizado, utilizando-se KIO3, num processo representado pelas seguintes equações químicas não balanceadas:
IO3– + I– + H+ ⇆ I2+ H2O (produção de iodo) I2+ S2O32– ⇆ S4O62– + I– (titulação do iodo formado)
Para a resolução desta questão, estas equações deverão ser balanceadas.
Nesse processo, cada milimol de iodato, após adicionada a solução de iodeto, consumirá
IO3– + I– + H+ ⇆ I2+ H2O (produção de iodo) I2+ S2O32– ⇆ S4O62– + I– (titulação do iodo formado)
Para a resolução desta questão, estas equações deverão ser balanceadas.
Nesse processo, cada milimol de iodato, após adicionada a solução de iodeto, consumirá