Questões de Concurso Público Prefeitura de Pitangueiras - SP 2024 para Químico
Foram encontradas 10 questões
Ano: 2024
Banca:
Instituto Consulplan
Órgão:
Prefeitura de Pitangueiras - SP
Prova:
Instituto Consulplan - 2024 - Prefeitura de Pitangueiras - SP - Químico |
Q2371361
Química
Certo químico precisou determinar a concentração real de uma solução recém-preparada de soda cáustica. Para isso, o profissional
empregou uma solução de ácido oxálico (estrutura química fornecida na imagem), com concentração de 0,1 mol/L. Como titulado,
o químico adicionou 10 mL da solução de interesse, acrescidos de 10 mL de água purificada. A imagem apresenta informações
pertinentes acerca do procedimento:
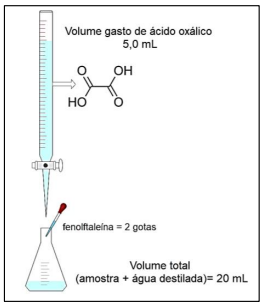
Considerando as informações fornecidas e a imagem, a concentração real da solução preparada de NaOH será de:

Considerando as informações fornecidas e a imagem, a concentração real da solução preparada de NaOH será de:
Ano: 2024
Banca:
Instituto Consulplan
Órgão:
Prefeitura de Pitangueiras - SP
Prova:
Instituto Consulplan - 2024 - Prefeitura de Pitangueiras - SP - Químico |
Q2371362
Química
Em laboratórios de química, o espectrofotômetro UV-Visível é um dos equipamentos mais utilizados. A imagem a seguir
apresenta parte do espectro de absorção eletrônica de determinada substância, com absorbância de 0,6 em 650 nanômetros
(nm). A análise foi realizada em cubeta de 1 cm de caminho óptico:
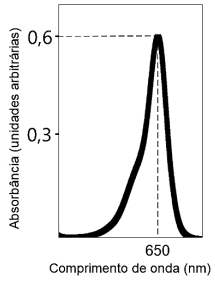
Considerando o espectro coletado e um coeficiente de absortividade molar de 40.000 L/(mol.cm) para o analito, a concentração da substância em µmol/L (micromol/L) determinada pela Lei de Lambert-Beer será de, aproximadamente:

Considerando o espectro coletado e um coeficiente de absortividade molar de 40.000 L/(mol.cm) para o analito, a concentração da substância em µmol/L (micromol/L) determinada pela Lei de Lambert-Beer será de, aproximadamente:
Ano: 2024
Banca:
Instituto Consulplan
Órgão:
Prefeitura de Pitangueiras - SP
Prova:
Instituto Consulplan - 2024 - Prefeitura de Pitangueiras - SP - Químico |
Q2371363
Química
Sobre a Espectroscopia UV-Visível, marque V para as afirmativas verdadeiras e F para as falsas.
( ) Geralmente, a técnica espectroscópica prescinde do uso de branco como referência antes de todas as medidas.
( ) Transições eletrônicas que implicam mudança de spin do elétron são permitidas e, frequentemente, originam bandas com elevada intensidade de absorção.
( ) A intensidade e o perfil das bandas de absorção do composto são independentes do solvente utilizado.
A sequência está correta em
( ) Geralmente, a técnica espectroscópica prescinde do uso de branco como referência antes de todas as medidas.
( ) Transições eletrônicas que implicam mudança de spin do elétron são permitidas e, frequentemente, originam bandas com elevada intensidade de absorção.
( ) A intensidade e o perfil das bandas de absorção do composto são independentes do solvente utilizado.
A sequência está correta em
Ano: 2024
Banca:
Instituto Consulplan
Órgão:
Prefeitura de Pitangueiras - SP
Prova:
Instituto Consulplan - 2024 - Prefeitura de Pitangueiras - SP - Químico |
Q2371364
Química
Ao avaliar a cinética de degradação de um corante em estudos in vitro, o químico obteve os seguintes resultados:
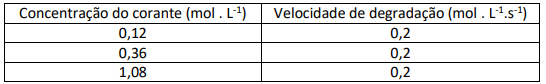
Os dados experimentais apresentados na tabela sugerem uma lei cinética de degradação de ordem:

Os dados experimentais apresentados na tabela sugerem uma lei cinética de degradação de ordem:
Ano: 2024
Banca:
Instituto Consulplan
Órgão:
Prefeitura de Pitangueiras - SP
Prova:
Instituto Consulplan - 2024 - Prefeitura de Pitangueiras - SP - Químico |
Q2371365
Química
Um químico, em uma estação de tratamento de efluente industrial, depara-se com uma amostra contendo PbSO4 proveniente de
processos industriais anteriores. A legislação ambiental exige que a concentração de chumbo (Pb2+) na água tratada seja mantida
abaixo do limite permitido. O químico decide, então, utilizar o método do equilíbrio iônico de solubilidade para determinar a
concentração máxima de íons de chumbo que pode estar presente antes que o Pb²⁺ comece a precipitar na forma de sulfato de
chumbo. Essa análise é importante para que o profissional qualifique a solução saturada para então adotar estratégias de
tratamento. A equação química do equilíbrio de solubilidade é:
PbSO4 (s) ⇌ Pb2+(aq) + SO2–4 (aq)
A constante de equilíbrio (Kps) para essa reação é conhecida e equivale a 1,0 × 10−8 . Com base no equilíbrio iônico de solubilidade, a concentração máxima de íons de chumbo (Pb²⁺) na água tratada antes que o PbSO₄ comece a precipitar será de:
PbSO4 (s) ⇌ Pb2+(aq) + SO2–4 (aq)
A constante de equilíbrio (Kps) para essa reação é conhecida e equivale a 1,0 × 10−8 . Com base no equilíbrio iônico de solubilidade, a concentração máxima de íons de chumbo (Pb²⁺) na água tratada antes que o PbSO₄ comece a precipitar será de: