Questões de Concurso Público IF-RS 2018 para Técnico de Laboratório - Química
Foram encontradas 29 questões
A seguir são apresentadas as fórmulas estruturais do Aspartame e do Neotame:
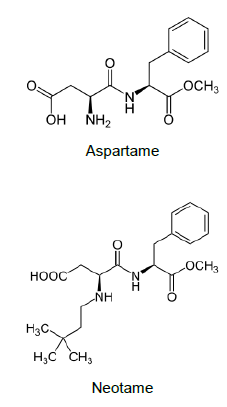
A alternativa que contém a função orgânica que NÃO está presente na estrutura do Aspartame e do Neotame é
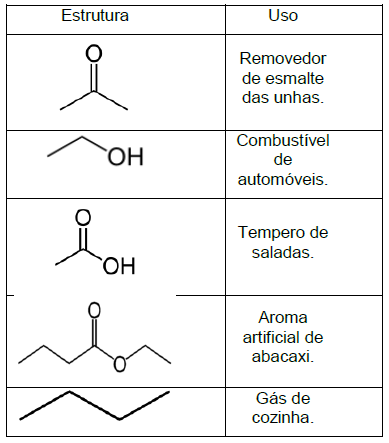
A sequência CORRETA que apresenta o nome dos compostos orgânicos, de cima para baixo, é:
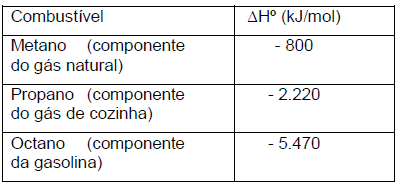
Com base nesses dados, são feitas as seguintes afirmativas:
I. O poder calorífico do Propano é maior que do Octano. II. A queima de um mol de Metano absorve cerca de 50 kJ de energia. III. A energia proveniente da queima de 1 kg de Metano é cerca de 2,8 vezes menor que a energia da queima de 1 kg de Propano.
Assinale a alternativa em que toda(s) a(s) afirmativa(s) está(ão) CORRETA(S):
N2O5(g) + H2O(l) → 2 HNO3(aq)
Utilizando as equações termoquímicas:
N2(g) + 3 O2(g) + H2(g) → 2 HNO3(aq) ∆H= – 415 kJ 2 H2(g) + O2(g) → 2 H2O (l) ∆H= – 572 kJ 2 N2(g) + 5 O2(g) → 2 N2O5(g) ∆H = + 22 kJ
Assinale a alternativa que contém o valor da entalpia envolvida na obtenção de quatro mols de ácido nítrico:
“Normal”: 60 g de sacarose em frascos de 500 mL. “Light” (teor reduzido de açúcar): 100 g de sacarose em frascos de 1 L. Dado: densidade do refrigerante a 20 °C = 1,04 g/mL
Assinale a alternativa em que a afirmativa está INCORRETA:
Amostra X: Pesar 18 g de Polipropilenoglicol; diluir até 200 mL. Amostra Y: Pesar 20 g de Polipropilenoglicol; diluir até 200 mL. Amostra Z: misturar as amostras X e Y; diluir até o volume de 500 mL.
Assinale a alternativa que apresenta a concentração CORRETA de polipropilenoglicol na solução Z:
( ) Tampão é uma solução que contém concentrações suficientes de um ácido fraco e de sua base conjugada. ( ) O ácido acético possui pKa = 4,75. Uma solução de ácido acético (HAc) e acetato de sódio (NaAc) funcionará como um tampão eficaz na faixa de pH de 2,75 – 6,75. ( ) Uma solução tampão, de pKa = 4,74, formada por HAc 0,1 mol/L e NaAc 0,1 mol/L, tem pH = 4,74. ( ) Quanto maior for a variação de pH após a adição de ácido forte ou de base forte, mais eficiente será a solução tampão.
___ P + ___ HNO3 + __ H2O →__ H3PO4 + 5 NO
Após balanceamento, a soma dos coeficientes estequiométricos dos reagentes é __________. Nesta reação, o __________sofre oxidação e o __________sofre redução.
Assinale a alternativa que apresenta as palavras que preenchem CORRETAMENTE as lacunas, na ordem em que aparecem no texto:
Fe+2(aq) + 2 e- → Fe(s) E° = - 0,44 V Pb+2(aq) + 2 e- → Pb(s) E°= - 0,13 V
E considerando a formação de uma pilha, são feitas as seguintes afirmativas:
I. A reação que ocorre no cátodo é Pb+2(aq) + 2 e- → Pb(s). II. A Pilha pode ser representada por Fe2+(aq) / Fe(s) // Pb2+(aq) / Pb(s). III. A voltagem da pilha é igual a 0,31 V. IV. A reação não é espontânea.
Assinale a alternativa em que todas as afirmativas estão CORRETAS:
Fatores que influenciam a velocidade das reações químicas: A. superfície de contato.
B. catalisador. C. concentração. D. temperatura. E. inibidor.
( ) Um alimento é congelado para ser conservado por mais tempo. ( ) Uma barra de ferro oxida mais rapidamente se transformada em palha de aço. ( ) Gases resultantes do escapamento dos automóveis são convertidos em gases menos nocivos, contribuindo para a diminuição da poluição atmosférica. ( ) Para evitar que um alimento deteriore em pouco tempo, pode-se embalá-lo a vácuo. ( ) Os Parabenos são substâncias muito usadas na indústria com a finalidade de conservar cosméticos, permitindo que o prazo de validade dos mesmos seja maior.
Assinale a sequência que ilustra o preenchimento CORRETO dos parênteses, de cima para baixo:
A alternativa que apresenta apenas as substâncias classificados como óxidos é:
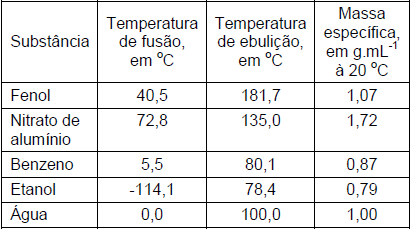
Sobre essas substâncias, quando submetidas à pressão de 1 atmosfera, são feitas as seguintes afirmativas:
I. Quando aquecido à temperatura de 50 oC, o fenol se encontrará no estado líquido. II. O nitrato de alumínio é um sólido mesmo quando se encontra na temperatura de 70 oC. III. A massa, em gramas, de 1 L de benzeno será a mesma de 1 L de fenol. IV. A massa da mistura de 150 mL de água com 150 mL de etanol será 300 g.
Assinale a alternativa em que todas as afirmativas estão CORRETAS:
I. Teremos duas fases nos frascos B e C, pois tanto a água quanto o etanol não estabelecem ligações de hidrogênio com a gasolina. II. No frasco A teremos uma única fase, pois a água e o álcool etílico são solúveis em todas as proporções dadas as ligações de hidrogênio que se estabelecem entre suas moléculas. III. Ao misturarmos os três frascos, observaremos três fases distintas, pois as densidades das substâncias são diferentes.
Assinale a alternativa em que toda(s) a(s) afirmativa(s) está(ão) CORRETA(S):
KHC8H4O4 + NaOH → NaKH(C8H4O4) + H2O
Assinale a alternativa que responde CORRETAMENTE à questão.
A alternativa que completa CORRETAMENTE a lacuna é:
I. Átomos que apresentam seus elétrons de valência exclusivamente no subnível s possuem maior eletronegatividade do que átomos com elétrons de valência no subnível p. II. O caráter iônico de uma ligação química depende da diferença de eletronegatividade entre os átomos envolvidos. III. Todos os halogênios apresentam 7 elétrons no subnível p do último nível eletrônico.
São VERDADEIRAS apenas a(s) afirmativa(s):