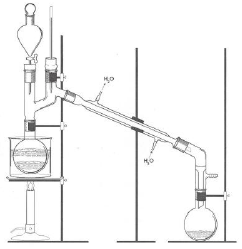
Questões de Concurso Público IF-BA 2014 para Técnico de Laboratório - Química
Foram encontradas 18 questões
Al(s) + I2(s) → AlI3(s)
Com base nessas informações, partindo-se de 1,40 moles de Al e 3,00 moles de I₂, o reagente limitante e o rendimento teórico do produto serão respectivamente:
Coloração típica de chamas devido à presença de alguns cátions em estado excitado
Elemento Cor da chama Elemento Cor da chama
Antimônio Azul-esverdeada Cobre Verde
Arsênio Azul Estrôncio Vermelho-tijolo
Bário Verde-amarelada Lítio Carmin
Cálcio Alaranjada Potássio Violeta
Chumbo Azul Sódio Amarela
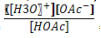 = 1,75 x 10-5 e Massa molar de
NaOAc = 82,034 g )
= 1,75 x 10-5 e Massa molar de
NaOAc = 82,034 g )