Questões de Concurso Público COMPESA 2016 para Analista de Saneamento - Químico
Foram encontradas 4 questões
Para uma determinada pratica em laboratório é necessário o preparo de 200 mL de solução 0,5 mol.L–1 de ácido nítrico a partir de uma solução concentrada desse ácido. A solução concentrada é identificada por: 65%(m/m) e densidade 1,4g.cm–3 .
O volume a ser utilizado dessa solução é de, aproximadamente,
Dados: Massas molares: H = 1g.mol-1 ; N = 14g.mol-1 ; O = 16g.mol-1
Na preparação de uma curva de calibração para analisar nitrato em amostras de água por meio da técnica de cromatografia iônica, um analista utilizou uma solução padrão de concentração inicial 99,6 mg.L–1 e preparou diferentes volumes de soluções com diferentes concentrações.
A tabela a seguir apresenta volumes utilizados da solução padrão e concentrações das soluções preparadas.
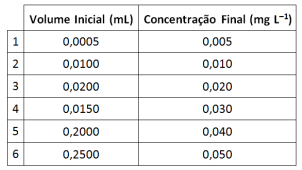
Os maiores volumes (em mL) preparados foram os
correspondentes às soluções
Os sais de nitrato são compostos iônicos muito solúveis em água. Quando se coloca 1 mol de nitrato de cálcio em 1 litro de água ocorre a formação de uma solução na qual os íons estão separados e solvatados por moléculas de água.
Nessa solução, as concentrações em mol.L-1 dos íons cálcio e nitrato, presentes na solução são, respectivamente,
Para padronizar uma solução de ácido clorídrico, um analista pesou 0,764 g de bórax e transferiu quantitativamente para um erlenmeyer, dissolvendo em 50 mL de água destilada. Esta solução foi titulada até coloração rosa com o ácido clorídrico em presença de três gotas do indicador vermelho de metila consumindo 40,00 mL do ácido clorídrico.
A concentração do ácido titulado (em mol.L-1 ) é igual a
Dados: Massa molar do bórax (Na2B4O7.10H2O) = 382g.mol-1