Questões de Concurso Público Prefeitura de São José - SC 2018 para Professor - Química
Foram encontradas 5 questões
Num reator em forma de balão com capacidade de 1,0 litro, numa temperatura de 100,0°C, foram adicionados 1,0 mol de H2 (g) e 1,0 mol de I2 (g).
A figura abaixo apresenta a variação das concentrações com o tempo de H2 (g), I2 (g) e de HI(g).
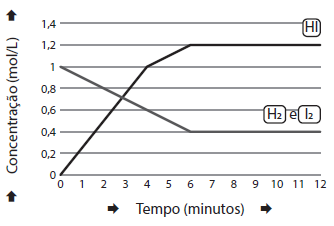
A reação é representada pela equação:
H2
(g) + I2
(g) → 2HI(g)
O valor da constante de equilíbrio é igual a:
dentifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ).
( ) De acordo com o princípio da conservação da energia, a energia não pode ser criada nem destruída, mas somente transformada de uma espécie em outra.
( ) O estado de equilíbrio químico ocorre no momento em que o sistema reacional estaciona e a reação é completada.
( ) Aproximadamente 1,3 kW m-2 da energia radiante solar atinge a Terra, porém somente cerca de 5% desta energia é convertida em carboidratos pela fotossíntese.
( ) Denomina-se “processo exotérmico” aquele que absorve calor e apresenta ∆H > 0.
( ) Aumentar a quantidade dos reagentes é a única maneira de se elevar o valor da constante de equilíbrio de uma reação química.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
Sabendo-se que o cloreto de prata, AgCl, e o brometo de prata, AgBr, são muito pouco solúveis em soluções aquosas, calcule o produto de solubilidade das substâncias pouco solúveis a partir das suas solubilidades molares:
1. AgCl = 1,265 × 10–5 mol.L–1
2. AgBr = 8,800 × 10–7 mol.L–1
Assinale a alternativa correta.
Identifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ).
( ) O valor numérico da constante de equilíbrio de reações químicas sofre alteração quando há variação da temperatura da reação.
( ) A velocidade de reações químicas é alterada pela presença de catalisadores e estes (catalisadores) são totalmente consumidos durante a reação.
( ) A diminuição da temperatura de uma reação exotérmica desfavorece a formação de produtos.
( ) O tempo necessário para que a concentração do reagente se reduza a um quarto da concentração inicial é denominado de meia-vida.
( ) As leis de velocidades são determinadas experimentalmente e geralmente não podem ser escritas a partir da estequiometria da equação química da reação.
Assinale a alternativa que indica a sequência correta, de cima para baixo.