Questões de Concurso Público Transpetro 2018 para Engenheiro Júnior - Processamento (Químico)
Foram encontradas 49 questões
Ano: 2018
Banca:
CESGRANRIO
Órgão:
Transpetro
Prova:
CESGRANRIO - 2018 - Transpetro - Engenheiro Júnior - Processamento (Químico) |
Q1090271
Engenharia Química e Química Industrial
O diagrama de fases pode ser representado por gráficos
em função de P x T a partir das equações de pressão de
vapor de um ou mais componentes. Na construção desses gráficos, é possível encontrar a temperatura normal
de ebulição, utilizando-se a equação para a pressão de
vapor do líquido a pressão atmosférica. Sabe-se que as
pressões saturadas de vapor para as fases sólida e líquida se cruzam no ponto triplo e que a temperatura, Tpt, do
ponto triplo é de 1260 K.
As equações para a pressão de vapor do NaF sólido e líquido com a pressão são, respectivamente, as seguintes:
Inp =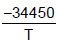 - 2,01lnT + 33,740 Inp =
- 2,01lnT + 33,740 Inp = 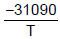 - 2,52lnT + 34,660
- 2,52lnT + 34,660
O calor de fusão, ∆H, do fluoreto de sódio (NaF), no ponto triplo, em KJ, é
Dado pressão na equação em (atm), temperatura na equação em (K) e constante dos gases R = 8,3144 JK-1 mol-1
As equações para a pressão de vapor do NaF sólido e líquido com a pressão são, respectivamente, as seguintes:
Inp =
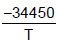 - 2,01lnT + 33,740 Inp =
- 2,01lnT + 33,740 Inp = 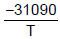 - 2,52lnT + 34,660
- 2,52lnT + 34,660 O calor de fusão, ∆H, do fluoreto de sódio (NaF), no ponto triplo, em KJ, é
Dado pressão na equação em (atm), temperatura na equação em (K) e constante dos gases R = 8,3144 JK-1 mol-1
Ano: 2018
Banca:
CESGRANRIO
Órgão:
Transpetro
Prova:
CESGRANRIO - 2018 - Transpetro - Engenheiro Júnior - Processamento (Químico) |
Q1090272
Engenharia Química e Química Industrial
Uma bola é inflada com 0,005 L de um gás ideal e está
inicialmente na superfície de um tanque com água, conforme representado na Figura abaixo. Essa bola é capaz
de se expandir ou se comprimir de acordo com as variações de pressão.
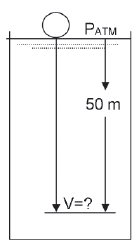
Qual o volume dessa bola, quando ela atingir a profundidade de 50 metros?
Dado A temperatura é constante e igual a 25°C. 1 atm = 10 m

Qual o volume dessa bola, quando ela atingir a profundidade de 50 metros?
Dado A temperatura é constante e igual a 25°C. 1 atm = 10 m
Ano: 2018
Banca:
CESGRANRIO
Órgão:
Transpetro
Prova:
CESGRANRIO - 2018 - Transpetro - Engenheiro Júnior - Processamento (Químico) |
Q1090273
Engenharia Química e Química Industrial
Usando os conceitos de Entropia (S) aplicados às reações
químicas, observe a reação química 2A(l) + B(s) → 2C(g).
A Entropia dessa reação química varia do seguinte modo:
Ano: 2018
Banca:
CESGRANRIO
Órgão:
Transpetro
Prova:
CESGRANRIO - 2018 - Transpetro - Engenheiro Júnior - Processamento (Químico) |
Q1090274
Engenharia Química e Química Industrial
O tempo espacial expressa o tempo necessário para processar um volume de reator considerando-se a alimentação do fluido nas condições de entrada. Considere um
reator tubular de 200 L que é alimentado com uma vazão
volumétrica de 5 L/s.
O tempo espacial, em minutos, é
O tempo espacial, em minutos, é
Ano: 2018
Banca:
CESGRANRIO
Órgão:
Transpetro
Prova:
CESGRANRIO - 2018 - Transpetro - Engenheiro Júnior - Processamento (Químico) |
Q1090275
Engenharia Química e Química Industrial
A Equação de Arrhenius, k = k0
exp(-E/RT), pode ser escrita na forma logarítmica gerando a expressão ln k = ln k0
– E/RT. Os
dados apresentados na Tabela a seguir referem-se à reação 2A → 2B + C.
T (°C) T (K) K (L mol-1 s-1) ln k 161,63 434,78 148,42 5,00 104,20 377,35 1 0 60,18 333,33 0,0067 -5,0
A partir desses dados plotados na Figura abaixo, calcula-se a Energia de Ativação desta reação.
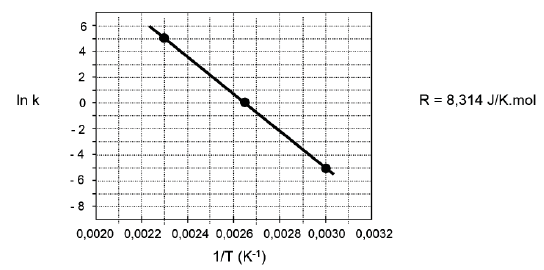
O valor da Energia de Ativação expresso em Joules/mol é
T (°C) T (K) K (L mol-1 s-1) ln k 161,63 434,78 148,42 5,00 104,20 377,35 1 0 60,18 333,33 0,0067 -5,0
A partir desses dados plotados na Figura abaixo, calcula-se a Energia de Ativação desta reação.

O valor da Energia de Ativação expresso em Joules/mol é