Questões de Concurso Público Petrobras 2011 para Químico de Petróleo Júnior
Foram encontradas 14 questões
Ano: 2011
Banca:
CESGRANRIO
Órgão:
Petrobras
Prova:
CESGRANRIO - 2011 - Petrobrás - Químico de Petróleo Júnior |
Q88998
Química
A combinação das Leis de Boyle, de Charles e de Avogadro gerou a Lei dos Gases Ideais, representada pela expressão PV = nRT. Essa é uma equação de estado que descreve a resposta de um gás ideal a mudanças de pressão, volume, temperatura e quantidade de moléculas. Entretanto, vários processos industriais e pesquisas em laboratório usam gases sob alta pressão ou em condições muito baixas de temperatura, condições às quais as leis dos gases ideais não são exatamente obedecidas. Nesses casos, o comportamento se assemelha ao dos gases reais. Em relação à teoria dos gases reais e ideais, afirma-se que
Ano: 2011
Banca:
CESGRANRIO
Órgão:
Petrobras
Prova:
CESGRANRIO - 2011 - Petrobrás - Químico de Petróleo Júnior |
Q88999
Química
Composição de um calcário dolomítico
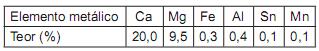
Um recurso empregado para controlar a emissão de poluentes consiste na adição de calcário ao leito fluidizado em que se queimam carvões contendo enxofre. Considerando-se o uso de um calcário dolomítico com a composição indicada acima, qual a quantidade estequiométrica, em kg, a ser utilizada por tonelada de carvão no caso de um combustível com 1,6% de enxofre (S)?
Dado: Leve em conta apenas o óxido de cálcio na eficiência do processo.

Um recurso empregado para controlar a emissão de poluentes consiste na adição de calcário ao leito fluidizado em que se queimam carvões contendo enxofre. Considerando-se o uso de um calcário dolomítico com a composição indicada acima, qual a quantidade estequiométrica, em kg, a ser utilizada por tonelada de carvão no caso de um combustível com 1,6% de enxofre (S)?
Dado: Leve em conta apenas o óxido de cálcio na eficiência do processo.
Ano: 2011
Banca:
CESGRANRIO
Órgão:
Petrobras
Prova:
CESGRANRIO - 2011 - Petrobrás - Químico de Petróleo Júnior |
Q89000
Química
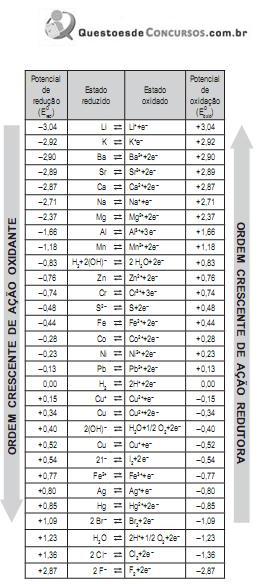
O cobre pode ser obtido por processamento hidrometalúgico de minérios ou concentrados. A rota usual consiste em lixiviação ácida, purificação por extração com solventes e obtenção final por eletrorredução do metal em soluções ácidas de sulfato de cobre. Com base na tabela acima, qual impureza prejudica significativamente a eficiência de corrente nessa última etapa do processo?
Ano: 2011
Banca:
CESGRANRIO
Órgão:
Petrobras
Prova:
CESGRANRIO - 2011 - Petrobrás - Químico de Petróleo Júnior |
Q89001
Química
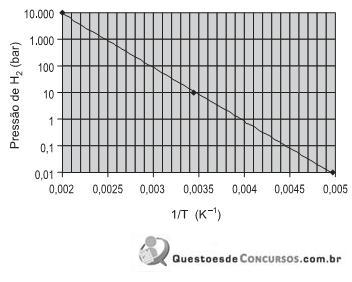
O armazenamento de hidrogênio em volumes reduzidos pode ser conseguido por meio da formação de hidretos metálicos. O gráfico de Van’t Hoff apresentado acima exibe a pressão de equilíbrio de hidrogênio, em função da temperatura para a seguinte reação:
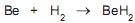
Qual a variação de entalpia, em kJ, estimada para essa reação?
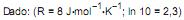
Ano: 2011
Banca:
CESGRANRIO
Órgão:
Petrobras
Prova:
CESGRANRIO - 2011 - Petrobrás - Químico de Petróleo Júnior |
Q89002
Química
Para se determinar o teor de cloreto em 1 litro de uma solução salina pelo método de Volhard, retirou-se uma alíquota de 25 mL da mesma, que foi tratada com 40 mL de uma solução padrão de nitrato de prata com concentração 0,150 M. Após a precipitação quantitativa do cloreto na forma de AgCl, titulou-se o excesso de prata remanescente com uma solução padrão de KSCN 0,200 M, contendo íons Fe3+ como indicador. O volume de titulante gasto para se atingir o ponto de equivalência foi de 5 mL. Com base nesses dados, conclui-se que a massa de cloro presente na forma de cloreto na solução inicial é, aproximadamente, de