Questões de Concurso Público CESMAC 2016 para Processo Seletivo Tradicional-2017.1- AGRESTE
Foram encontradas 6 questões
X: 1s2 Y: 1s2 2s2 2p5 Z: 1s2 2s2 2p6 3s2 3p5
Com relação a esses elementos químicos (X, Y e Z), as seguintes afirmações foram feitas:
1) X apresenta a maior energia de ionização. 2) Y e Z apresentam o mesmo raio atômico. 3) Y e Z pertencem ao mesmo grupo da Tabela Periódica.
Está(ão) correta(s) a(s) afirmativa(s):
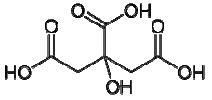
três afirmações foram feitas:
1) A molécula do ácido cítrico apresenta três carbonos com hibridização sp2 .
2) O citrato de sódio é um composto iônico com fórmula química C6H5Na3O7.
3) O fosfato de cálcio tem fórmula Ca2(PO4)3.
Está(ão) correta(s) a(s) afirmativa(s):
CO(g) + CH3OH(l) → CH3COOH(l).
Utilizando os valores das entalpias de formação padrão da tabela a seguir, calcule a entalpia padrão da reação, ∆H°, e determine se a mesma é endotérmica ou exotérmica.
Composto Entalpia de formação ∆Hf°, kJ.mol−1
CO(g) −110,53
CH3OH(l) −238,86
CH3COOH(l) −484,50
4 Au(s) + 8 NaCN(aq) + O2(g) + 2 H2O(l) → 4 NaAu(CN)2(aq) + 4 NaOH(aq)
Com relação à reação acima, podemos afirmar que:
1. O NOX do Au varia de zero para +1; assim, o ouro sofre oxidação e, portanto, é o agente redutor.
2. É uma reação redox, mas não há variação no número de oxidação do sódio.
3. Cada mol de O2 recebe 4 mol de elétrons.
Está(ão) correta(s) a(s) afirmativa(s):