Questões ENEM de Química - Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess.
Foram encontradas 15 questões
Grande parte da atual frota brasileira de veículos de passeio tem tecnologia capaz de identificar e processar tanto o etanol quanto a gasolina. Quando queimados, no interior do motor, esses combustíveis são transformados em produtos gasosos, num processo com variação de entalpia menor que zero (∆H < 0). Esse processo necessita de uma energia de ativação, a qual é fornecida por uma centelha elétrica.
O gráfico que esboça a variação da energia potencial no
progresso da reação é representado por:
2 H2 (g) + O2 (g) → 2 H2O (g)
Um cilindro contém 1 kg de hidrogênio e todo esse gás foi queimado. Nessa reação, são rompidas e formadas ligações químicas que envolvem as energias listadas no quadro.
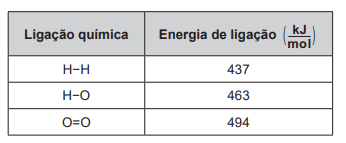
Massas molares ( g/mol ): H2 = 2; O2 = 32; H2O = 18.
Qual é a variação da entalpia, em quilojoule, da reação de combustão do hidrogênio contido no cilindro?
O valor correspondente à energia consumida para que o motorista de um carro econômico, movido a álcool, percorra 400 km na condição de máximo rendimento é mais próximo de
Glicólise é um processo que ocorre nas células, convertendo glicose em piruvato. Durante a prática de exercícios físicos que demandam grande quantidade de esforço, a glicose é completamente oxidada na presença de O2. Entretanto, em alguns casos, as células musculares podem sofrer um déficit de O2 e a glicose ser convertida em duas moléculas de ácido lático. As equações termoquímicas para a combustão da glicose e do ácido lático são, respectivamente, mostradas a seguir:
C6H12O6 (s) + 6 O2 (g) → 6 CO2 (g) + 6 H2O (l) ∆cH = −2 800 kJ
CH3CH(OH)COOH (s) + 3 O2 (g) → 3 CO2 (g) + 3 H2O (l) ∆cH = −1 344 kJ
O processo anaeróbico é menos vantajoso energeticamente porque
Por meio de reações químicas que envolvem carboidratos, lipídeos e proteínas, nossas células obtêm energia e produzem gás carbônico e água. A oxidação da glicose no organismo humano libera energia, conforme ilustra a equação química, sendo que aproximadamente 40% dela é disponibilizada para atividade muscular.
C6H12O6( s ) + 6 O2 (g) → 6 CO2 (g) + 6 H2O (I) ΔcH= -2 800 kJ
Considere as massas molares (em g mol-1): H = 1; C=12; O = 16.
LIMA, L. M.; FRAGA, C.A. M.; BARREIRO, E. J. Química na saúde. São Paulo: Sociedade Brasileira de Química, 2010 (adaptado).
Na oxidação de 1,0 grama de glicose, a energia obtida
para atividade muscular, em quilojoule, é mais próxima de