Questões de Concurso Público SEDUC-PE 2016 para Professor de Química
Foram encontradas 4 questões
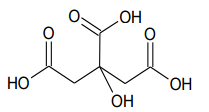
Assinale a opção que expressa a acidez da amostra. Dados. Massa molar. Ácido Cítrico: 192 g.mol –1 .
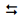 H2
(g) + I2
(g) foi estudada por inúmeros
pesquisadores em diversas temperaturas e condições iniciais. Em
um dos estudos, a reação foi conduzida em determinada
temperatura constante e em vaso de 1,00 L, carregado
inicialmente apenas com HI. Verificou-se que, no equilíbrio,
apenas 20% do HI inicial se dissociaram. Com base nesses dados,
foi possível calcular a constante de equilíbrio da reação.
Assinale a opção que apresenta o valor correto da constante de
equilíbrio Kc.
H2
(g) + I2
(g) foi estudada por inúmeros
pesquisadores em diversas temperaturas e condições iniciais. Em
um dos estudos, a reação foi conduzida em determinada
temperatura constante e em vaso de 1,00 L, carregado
inicialmente apenas com HI. Verificou-se que, no equilíbrio,
apenas 20% do HI inicial se dissociaram. Com base nesses dados,
foi possível calcular a constante de equilíbrio da reação.
Assinale a opção que apresenta o valor correto da constante de
equilíbrio Kc.