Questões de Concurso Público SEED-PR 2021 para Professor - Química
Foram encontradas 8 questões
Ano: 2021
Banca:
CESPE / CEBRASPE
Órgão:
SEED-PR
Prova:
CESPE / CEBRASPE - 2021 - SEED-PR - Professor - Química |
Q1690267
Química
Texto associado
A exposição à radiação ultravioleta pode causar queimadura na pele, lesão em células epiteliais, alteração do DNA, inflamação, dilatação dos vasos sanguíneos, câncer, entre outros fatores adversos. O ozônio (O3) existente na estratosfera atua como um filtro dos raios ultravioletas provenientes do Sol.
Texto 10A2-I
A exposição à radiação ultravioleta pode causar queimadura na pele, lesão em células epiteliais, alteração do DNA, inflamação, dilatação dos vasos sanguíneos, câncer, entre outros fatores adversos. O ozônio (O3) existente na estratosfera atua como um filtro dos raios ultravioletas provenientes do Sol.
Antigamente, muitos sprays utilizavam
clorofluorcarbonos (CFCs) em sua composição. Esses CFCs
ficavam na atmosfera e reagiam com o ozônio, decompondo-o.
Em 1989, foi assinado um acordo internacional
denominado Protocolo de Montreal, por meio do qual mais de
130 países, incluído o Brasil, comprometeram-se a eliminar
progressivamente o uso dessas substâncias em sprays e outras
aplicações.
Um dos CFCs mais comuns possui fórmula CF2Cl2. Na
estratosfera, sob luz ultravioleta, ele sofre a seguinte reação.
CF2Cl2 → •CF2Cl + Cl•
O átomo livre de cloro (Cl•), por sua vez, pode
desencadear uma cascata de reações, como, por exemplo, as
apresentadas a seguir.
O3 (g) + Cl• (g) → O2 (g) + ClO• (g)
O3 (g) + ClO• (g) → 2 O2 (g) + Cl• (g)
Com base nas informações do texto 10A2-I, é correto afirmar
que a ação da radiação ultravioleta sobre o CF2Cl2 se deve
Ano: 2021
Banca:
CESPE / CEBRASPE
Órgão:
SEED-PR
Prova:
CESPE / CEBRASPE - 2021 - SEED-PR - Professor - Química |
Q1690269
Química
As substâncias A, B e C reagem entre si, produzindo as
substâncias D e E. A velocidade inicial dessa reação foi medida
para várias concentrações iniciais de A, B e C, à temperatura
constante, e os resultados obtidos são os mostrados na seguinte
tabela.
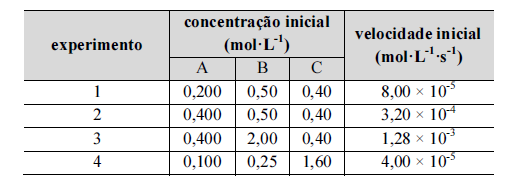
Com relação à situação hipotética precedente, assumindo-se v como a velocidade da reação e k como a constante de velocidade, é correto afirmar que a lei de velocidade dessa reação é dada por

Com relação à situação hipotética precedente, assumindo-se v como a velocidade da reação e k como a constante de velocidade, é correto afirmar que a lei de velocidade dessa reação é dada por
Ano: 2021
Banca:
CESPE / CEBRASPE
Órgão:
SEED-PR
Prova:
CESPE / CEBRASPE - 2021 - SEED-PR - Professor - Química |
Q1690270
Química
Alguns povos indígenas da Amazônia utilizam a casca da
quina (Coutarea hexandra) para extrair quinina, uma substância
que eles utilizam para tratar febre. Atualmente, a quinina é
utilizada no tratamento da malária e de arritmias cardíacas, além
de ser o flavorizante da água tônica. Os estudos sobre a cinética
de degradação da quinina por ácido estabeleceram que a lei de
velocidade dessa reação é dada por v = k [quinina] [ácido]2
, em
que v é a velocidade da reação e k é a constante de velocidade.
Nesses estudos, quando 1,0 × 10-4 mol/L de quinina foram
misturados com 5,0 × 10-3 mol/L de ácido, a velocidade da
reação medida foi de 2,4 × 10-3 mol·L-1·s-1.
Com base nessas informações, é correto afirmar que, se as concentrações iniciais de quinina e de ácido forem, respectivamente, de 0,250 mol/L e 0,160 mol/L, então a velocidade inicial da reação será igual a
Com base nessas informações, é correto afirmar que, se as concentrações iniciais de quinina e de ácido forem, respectivamente, de 0,250 mol/L e 0,160 mol/L, então a velocidade inicial da reação será igual a
Ano: 2021
Banca:
CESPE / CEBRASPE
Órgão:
SEED-PR
Prova:
CESPE / CEBRASPE - 2021 - SEED-PR - Professor - Química |
Q1690271
Química
O gás NO reage com o gás O3 conforme a seguinte
equação.
NO (g) + O3 (g) ⇌ NO2 (g) + O2 (g)
Estudos mostraram que, quando esses dois gases são colocados em um mesmo recipiente a 25 °C e 1 atm, cada molécula colide, em média, cerca de um bilhão de vezes por segundo com outras moléculas. Se todas essas colisões resultassem em formação de produto, a reação aconteceria em uma fração de segundo. Porém, não é isso que se observa empiricamente, sendo a reação muitíssimo mais lenta.
Nesse caso, para que a reação aconteça, a simples colisão entre as moléculas não é suficiente; é necessário, também, que
NO (g) + O3 (g) ⇌ NO2 (g) + O2 (g)
Estudos mostraram que, quando esses dois gases são colocados em um mesmo recipiente a 25 °C e 1 atm, cada molécula colide, em média, cerca de um bilhão de vezes por segundo com outras moléculas. Se todas essas colisões resultassem em formação de produto, a reação aconteceria em uma fração de segundo. Porém, não é isso que se observa empiricamente, sendo a reação muitíssimo mais lenta.
Nesse caso, para que a reação aconteça, a simples colisão entre as moléculas não é suficiente; é necessário, também, que
Ano: 2021
Banca:
CESPE / CEBRASPE
Órgão:
SEED-PR
Prova:
CESPE / CEBRASPE - 2021 - SEED-PR - Professor - Química |
Q1690272
Química
Texto associado
O álcool estearílico é usado na indústria de cosméticos para a produção de cremes, loções, máscaras capilares, entre outros, por ser compatível com vários tipos de emulsionantes e apresentar baixa irritabilidade na pele.

Texto 10A2-II
O álcool estearílico é usado na indústria de cosméticos para a produção de cremes, loções, máscaras capilares, entre outros, por ser compatível com vários tipos de emulsionantes e apresentar baixa irritabilidade na pele.
Devido a um problema técnico em uma das indústrias de
produção desse insumo, esse produto passou a ficar escasso no
mercado, o que levou uma indústria de cosméticos a considerar o
estearato de metila como possível alternativa para a produção do
álcool estearílico, a partir da hidrogenação do estearato de metila,
em solução de heptano, por meio da seguinte reação.
C19H38O2 (sol) + 2 H2 (g) → C18H37OH (sol) + CH3OH (sol)
A planta piloto dessa indústria de cosméticos é equipada
com um reator do tipo autoclave, que opera em temperatura
máxima de 200 °C e pressão máxima de 1.000 psi e que pode ser
utilizado para desenvolver o projeto. Para que a síntese do álcool
estearílico seja bem-sucedida, o químico resolveu testar várias
condições reacionais, a fim de descobrir qual delas proporcionará
a obtenção de maior quantidade de álcool estearílico
(rendimento) no menor tempo possível. Ele testou diversas
condições experimentais, tais como tempo de reação,
temperatura e pressão do reator, além de um catalisador
comercial à base de cobre. Os resultados dos testes são
mostrados na tabela a seguir. Sabe-se que o hidrogênio molecular
(H2) é instável a temperaturas acima de 200 °C.

Considerando a situação hipotética apresentada no texto 10A2-II,
assinale a opção correta, no que diz respeito ao catalisador.