Questões de Concurso Público Transpetro 2011 para Técnico Químico
Foram encontradas 5 questões
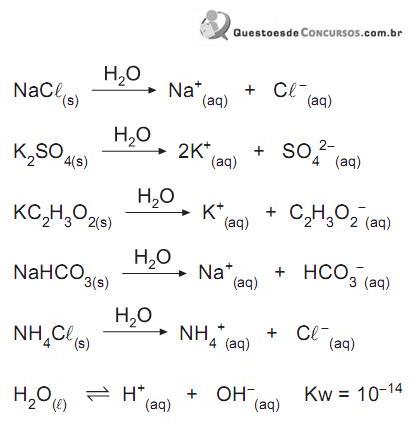
Considerando os íons dos sais que reagem com a água (hidrólise) e os que não reagem, afirma-se que a solução aquosa de
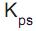 = 1,8 x 10-14 .
= 1,8 x 10-14 .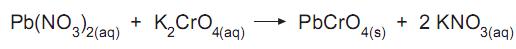
Se a uma solução aquosa contendo 0,01 mol de nitrato de chumbo II adiciona-se um volume pequeno de solução aquosa contendo 0,00002 mol de cromato de potássio, a quantidade máxima de precipitado de cromato de chumbo II que se forma é, em miligramas, aproximadamente igual a
Etapa I - Adição de quantidade conhecida de Ag+ para garantir a reação completa com todo íon haleto (X- ) e excesso de Ag+ na solução Ag+(aq) + X- (aq) → AgX(s)
Etapa II - Titulação do excesso de Ag+
Ag+ (aq) + SCN-(aq) → AgSCN(s)
Etapa III - Formação de complexo vermelho com o primeiro excesso de SCN-
SCN- + Fe3+→ [(Fe(SCN)] 2+(aq)
Com base nas informações relativas a cada etapa do processo, analise as afirmações a seguir.
I - O SCN- atua como indicador do ponto ? nal da titulação.
II - Pelo fato de o valor do
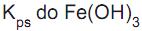 do Fe(OH) 3 ser 4 x 10-38 , o método de Volhard só funciona se o pH da solução for muito ácido.
do Fe(OH) 3 ser 4 x 10-38 , o método de Volhard só funciona se o pH da solução for muito ácido. III - O
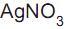 é um padrão primário, pois sofre alteração fotoquímica quando exposto à luz.
é um padrão primário, pois sofre alteração fotoquímica quando exposto à luz. IV - Nas titulações argentométricas, os sais de prata tipo AgX são bem solúveis em água.
É correto APENAS o que se afirma em
Considere as equações das seguintes reações que se encontram em condições de equilíbrio:
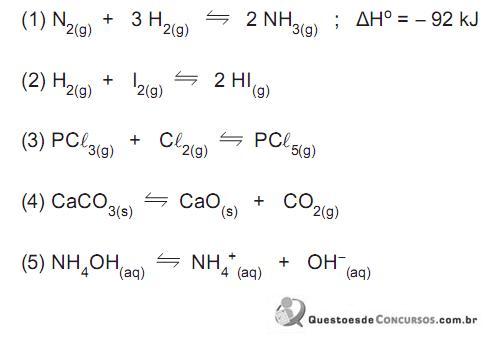
Sobre o deslocamento das reações de suas condições de equilíbrio por meio de ação externa, é INCORRETO afirmar que