Questões da Prova NC-UFPR - 2016 - UFPR - Vestibular
Foram encontradas 2 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
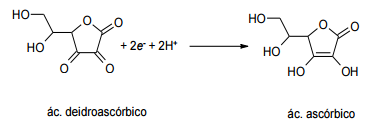
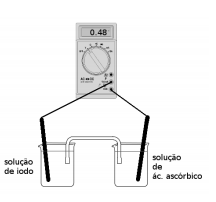 Sabendo que o potencial padrão de redução de iodo a iodeto é de E0 = 0,54 V,
o potencial padrão da reação abaixo é:
Sabendo que o potencial padrão de redução de iodo a iodeto é de E0 = 0,54 V,
o potencial padrão da reação abaixo é:
Dados – M (g mol-1 ): O = 16; Al = 27; Fe = 56.
A partir de 5 toneladas de minério, a quantidade (em toneladas) de alumínio metálico produzida por eletrólise ígnea é mais próxima de: