Questões da Prova IF-SP - 2019 - IF-SP - Química
Foram encontradas 24 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Pilhas alcalinas geram corrente elétrica por um período de tempo até 50% mais longo do que uma pilha seca do mesmo tamanho. Considere a reação abaixo, que ocorre nas pilhas alcalinas, e indique a alternativa que apresenta corretamente a reação que ocorre no catodo e no anodo.
Zn(s) + 2 MnO2
(s) → ZnO(s) + Mn2
O3
(s)
Uma reação do tipo 2A(g) + Z(g) →2T(g) foi monitorada variando-se a concentração dos reagentes. A velocidade de formação de T foi medida conforme a tabela abaixo.
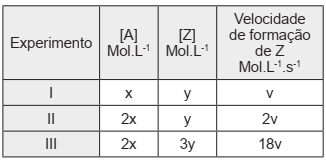
Determine a lei de velocidade e calcule a velocidade da reação em função de v se [A] for x e [Z]
for 3y.
Em um laboratório, preparou-se uma solução básica de NaOH, pesando-se uma determinada massa do reagente. Visto que o NaOH tem propriedade higroscópica, esta solução foi padronizada com um padrão primário, biftalato ácido de potássio. Para este procedimento, utilizou-se 25mL da solução de NaOH preparada e titulou-se com biftalato ácido de potássio. A massa de biftalato de potássio utilizada para padronização foi de 0,4000g. A reação entre titulante e titulado, pode ser representada pela equação:
KHC8H4O4(s) + NaOH(aq) → KNaC8H4O4(aq) + H2O(l)