Questões da Prova COMVEST UFAM - 2016 - UFAM - Técnico de Laboratório - Química
Foram encontradas 5 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Os indicadores são substâncias naturais ou sintéticas que apresentam cores bem distintas em ácido e básico. Para uma série de indicadores, as seguintes cores e faixa de pH sobre a qual a mudança de cor ocorre são apresentadas na tabela abaixo:

Assinale a alternativa que apresenta a afirmação
CORRETA:
Observe o frasco da figura a seguir que contém uma solução aquosa de ácido sulfúrico (H2SO4) utilizada em laboratório, e responda, sabendo que o volume da solução contida no frasco é 2,0 L:
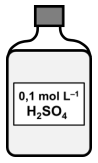
Qual o volume dessa solução necessário para obter
uma solução de 250 mL de H2SO4 com 0,025 mol L–1
?
Para atender aos procedimentos de rotinas laboratoriais, usamos vários tipos de soluções e concentrações. Para exemplificar, um técnico adicionou 100 mL de água destilada em 10 g de composto S, em pó e seco (CaCO3). A partir dos dados, obtiveram-se os resultados: (densidade da água, ρ = 1 g mL–1; massa molar do CaCO3 = 100 g mol–1):
I. Concentração comum: C = 0,1 g mL–1 .
II. Concentração molar: [X] = 0,5 mol L–1 .
III. Concentração molal: b = 1 mol kg–1 .
IV.Concentração percentual: %C = 10% m/V.
V. Fração molar de S: XS ≈ 0,1.
Assinale a alternativa correta: